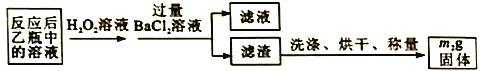
题目内容
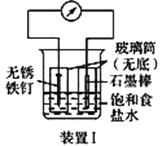
【题目】某实验小组想在实验室收集一瓶干燥纯净的氯气,其实验装置及药品如下。

(1)饱和NaCl的作用是________。
(2)氢氧化钠溶液吸收氯气的离子方程式为________。
(3)已知:不同温度下MnO2与盐酸反应的平衡常数
温度t/℃ | 50 | 80 | 110 |
平衡常数K | 3.104×10-4 | 2.347×10-3 | 1.293×10-2 |
MnO2与盐酸的反应是________(填“放热”或“吸热”)。
(4) 实验采用4 mol/L盐酸时,没有产生明显实验现象。小组学生猜测可能是反应速率慢,其原因可能是:________
Ⅰ 反应温度低;Ⅱ盐酸浓度低。
为探究条件对反应速率的影响,小组同学设计并完成以下实验:
序号 | 试剂 | 条件 | 现象 |
实验1 | 4 mol/L盐酸、MnO2 | 加热 | 无明显现象 |
实验2 | 7 mol/L浓盐酸、MnO2 | 不加热 | 无明显现象 |
实验3 | 7 mol/L浓盐酸、MnO2 | 加热 | 产生黄绿色气体 |
① 根据上述实验可知MnO2与盐酸反应产生氯气的条件为________。
② 小组学生进一步猜测:
Ⅰ.盐酸中c(H+)大小影响了反应速率。
Ⅱ.盐酸中c(Cl-) 大小影响了反应速率。
设计实验方案探究该小组学生的猜想。
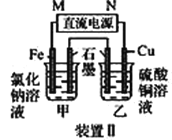
③ 为探究增大H+浓度,是增强了MnO2的氧化性,还是增强了Cl-的还原性,小组同学设计了如下实验。

实验中试剂X是________。接通电路,指针几乎不发生偏转。若向右侧容器中滴加浓H2SO4,指针偏转几乎没有变化;若向左侧容器中滴加等体积浓H2SO4,指针向左偏转。则可以得到的结论是________。
【答案】除去Cl2中的HCl 2OH-+Cl2=Cl-+ClO-+H2O 吸热 浓盐酸(或c(HCl)>7mol/L),加热 两个对比试验:实验 4 mol/L盐酸+硫酸溶液调节c(H+)为7 mol/L与MnO2混合加热;4 mol/L盐酸+NaCl调节c(Cl-)为7 mol/L与MnO2混合加热 4mol/L NaCl溶液 增大c(H+),可以增强MnO2的氧化性,对Cl-还原性几乎无影响。
【解析】
(1)实验室制取氯气、净化氯气、收集氯气、尾气处理;
(2)探究性实验,通过对比确定得出实验室制氯气是在浓盐酸与二氧化锰在加热的条件下发生的,设计实验验证盐酸中c(H+)大小影响了反应速率还是盐酸中c(Cl-) 大小影响了反应速率;
(3)通过改变c(H+)观察实验现象,确定增大H+浓度,是增强了MnO2的氧化性,还是增强了Cl-的还原性。
(1)收集氯气时,为了减少氯气在水中的溶解,采用排饱和NaCl溶液的方法;
(2)实验室制取、收集氯气,为了防止氯气污染环境,常用氢氧化钠溶液吸收氯气,其离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O;
(3)因为不同温度下MnO2与盐酸反应的平衡常数随着温度的升高而增大,所以MnO2与盐酸的反应是吸热反应;
(4)①实验1与实验3都是在加热条件下,实验1中盐酸的浓度比实验3中盐酸的浓度小,实验2与实验3盐酸的浓度都一样,但是实验2不加热,实验3加热,实验1、实验2都没有明显现象,而实验3产生黄绿色气体,说明影响MnO2与盐酸反应产生氯气的条件为浓盐酸(或c(HCl)>7mol/L),加热;
②盐酸中c(H+)大小影响了MnO2与盐酸反应的反应速率还是盐酸中c(Cl-) 大小影响了反应速率,做两个对比实验:实验Ⅰ. 4 mol/L盐酸+硫酸溶液调节c(H+)为7 mol/L与MnO2混合加热;实验Ⅱ.4 mol/L盐酸+NaCl调节c(Cl-)为7 mol/L与MnO2混合加热,然后观察实验现象;
③实验中试剂X是应该是4mol/L NaCl溶液,这样通过改变H+浓度做对比实验,来验证增大H+浓度,是增强了MnO2的氧化性,还是增强了Cl-的还原性,刚开始接通电路没有明显现象,当右侧增大H+浓度,没有明显现象,说明增大H+浓度对Cl-还原性几乎无影响;当左侧增大H+浓度,指针偏转,说明左侧增大H+浓度增强MnO2的氧化性。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】正丁醛是一种化工原料。某实验小组利用如图装置合成正丁醛。
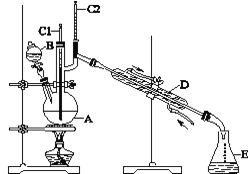
发生的反应如下:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为_______。
(2)加入沸石的作用是_____________。若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是___________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
【题目】在一定温度(T)时,X2(g)和H2反应生成HX的平衡常数如下表。
化学方程式 | K(T) |
F2+H2 | 1.8×1036 |
Cl2+H2 | 9.7×1022 |
Br2+H2 | 5.6×107 |
I2+H2 | 43 |
(1)I 有多种同位素,![]() 的中子数为______。
的中子数为______。
(2)用电子式表示HCl的形成过程______。
(3)下列说法正确的是______。
a 共价键的极性:HF>HCl
b 氯和溴氢化物性质的热稳定性:HCl>HBr
c 原子半径:S<Cl
d 酸性:H2SO4<HClO
(4)K的变化体现出X2化学性质的递变性,用原子结构解释X2得电子能力变化的原因______。