��Ŀ����
����Ŀ������ȩ��һ�ֻ���ԭ�ϡ�ijʵ��С��������ͼװ�úϳ�����ȩ��
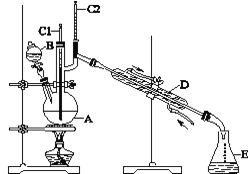
�����ķ�Ӧ���£�CH3CH2CH2CH2OH![]() CH3CH2CH2CHO����Ӧ��Ͳ������������б����£�
CH3CH2CH2CHO����Ӧ��Ͳ������������б����£�
�е�/�� | �ܶ�/(g��cm��3) | ˮ���ܽ��� | |
������ | 117.2 | 0.810 9 | �� |
����ȩ | 75.7 | 0.801 7 | �� |
ʵ�鲽�����£���6.0 g Na2Cr2O7����100 mL�ձ��У���30 mLˮ�ܽ⣬��5 mLŨ�����γɻ����Һ����������ҺС��ת����B�С���A�м���4.0 g�������ͼ�����ʯ�����ȡ�������������ʱ����ʼ�μ�B����Һ���μӹ����б��ַ�Ӧ�¶�Ϊ90��95 �棬��E���ռ�90 �����µ���֡�������ﵹ���Һ©���У���ȥˮ�㣬�л������������ռ�75��77 ����֣�����2.0 g���ش��������⣺
(1)ʵ���У�Na2Cr2O7��Һ��Ũ�������ӵ�˳��Ϊ_______��
(2)�����ʯ��������_____________�������Ⱥ���δ�ӷ�ʯ��Ӧ��ȡ����ȷ������__________��
(3)����װ��ͼ�У�D������������________��E������������________��
(4)��Һ©��ʹ��ǰ������еIJ�����________��
(5)������ȩ�ֲ�Ʒ���ڷ�Һ©���з�ˮʱ������ȩ��_______��(����������������)��
(6)��Ӧ�¶�Ӧ������90��95 �棬��ԭ����___________��
(7)��ʵ���У�����ȩ�IJ���Ϊ________%(���������λС��)��
���𰸡���Na2Cr2O7��Һ�еμ�Ũ���� ��ֹ���� ��ȴ�� ������ ��ƿ ��© �� ��֤����ȩ��ʱ���� ������������ȩ����һ������ 51.39��
��������
��Ũ������뵽Na2Cr2O7��Һ�У���װ�뵽B�У�����ʱ���ϵ��뷴Ӧ���з�����Ӧ�����ɶ�ȩ����ȩ�ķе�ȶ����е�ͣ����ȵ�90��95 �����õ���ֲ��ﶡȩ��Ʒ�����÷�Һ©�������ˮ���ټ�����ʡ�
(1)ʵ���У���ѭŨ����ϡ��ԭ��Na2Cr2O7��Һ��Ũ�������ӵ�˳��Ϊ��Na2Cr2O7��Һ�м���Ũ����ʴ�Ϊ����Na2Cr2O7��Һ�м���Ũ���ᡣ
(2)�����ʯ�������Ƿ�ֹ���С������Ⱥ���δ�ӷ�ʯ��Ӧ��ȡ����ȷ��������ȴ�ӣ��ʴ�Ϊ����ֹ���У���ȴ�ӡ�
(3)��������װ��ͼ�У����Եó�D������������ֱ�������ܣ�E��������������ƿ���ʴ�Ϊ��ֱ�������ܣ���ƿ��
(4)��Һ©��ʹ��ǰ�ȼ�©����ϴ����˱�����еIJ����Ǽ�©���ʴ�Ϊ����©��
(5)������ȩ�ֲ�Ʒ���ڷ�Һ©���з�ˮʱ��������ȩ���ܶȱ�ˮС���������ȩ���ϲ㣻�ʴ�Ϊ���ϡ�
(6)����ȩ�ķе���75.7�����������е���117.2������Ӧ�¶�Ӧ������90��95 ������ԭ���DZ�֤����ȩ��ʱ������������������ȩ����һ��������
(7)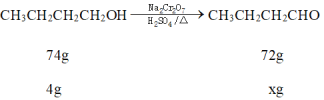
74g��4g = 72g��xg
���x=3.892g
![]() ���ʴ�Ϊ��51.39%��
���ʴ�Ϊ��51.39%��

 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�����Ŀ���±��г��ˢ١�������Ԫ�������ڱ��е�λ�ã�
�� ���� | ��A | 0 | ||||||
1 | ��A | ��A | ��A | ��A | ��A | ��A | ||
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | ||||
�밴Ҫ��ش��������⡣
(1)Ԫ�آٵ�Ԫ�ط�����_____________��
(2)Ԫ�آڵĵ��ʵ���ʽ��______________��
(3)Ԫ�آݵ�ԭ�ӽṹʾ��ͼ��______________��
(4)������Ԫ���У�λ�ڵ���������ԭ�Ӱ뾶��С����(��Ԫ�ط���)_______��
(5)������Ԫ�ص�����������У����������������Ԫ����(��Ԫ�ط���)_______��
(6)��ʢ��ˮ��С�ձ��м���Ԫ�آ۵ĵ��ʣ�������Ӧ�����ӷ���ʽΪ_______________________����������Ӧ�����Һ���ټ���Ԫ�آܵĵ��ʣ�������Ӧ�Ļ�ѧ����ʽΪ______________________��
����Ŀ��ijʵ��С������ʵ�����ռ�һƿ���﴿������������ʵ��װ�ü�ҩƷ���¡�

��1������NaCl��������________��
��2������������Һ�������������ӷ���ʽΪ________��
��3����֪����ͬ�¶���MnO2�����ᷴӦ��ƽ�ⳣ��
�¶�t/�� | 50 | 80 | 110 |
ƽ�ⳣ��K | 3.104��10-4 | 2.347��10-3 | 1.293��10-2 |
MnO2������ķ�Ӧ��________��������������������������
��4�� ʵ�����4 mol/L����ʱ��û�в�������ʵ������С��ѧ���²�����Ƿ�Ӧ����������ԭ������ǣ�________
�� ��Ӧ�¶ȵͣ�������Ũ�ȵ͡�
Ϊ̽�������Է�Ӧ���ʵ�Ӱ�죬С��ͬѧ��Ʋ��������ʵ�飺
��� | �Լ� | ���� | ���� |
ʵ��1 | 4 mol/L���ᡢMnO2 | ���� | ���������� |
ʵ��2 | 7 mol/LŨ���ᡢMnO2 | ������ | ���������� |
ʵ��3 | 7 mol/LŨ���ᡢMnO2 | ���� | ��������ɫ���� |
�� ��������ʵ���֪MnO2�����ᷴӦ��������������Ϊ________��
�� С��ѧ����һ���²⣺
��������c��H+����СӰ���˷�Ӧ���ʡ�
��������c��Cl���� ��СӰ���˷�Ӧ���ʡ�
���ʵ�鷽��̽����С��ѧ���IJ��롣
�� Ϊ̽������H+Ũ�ȣ�����ǿ��MnO2�������ԣ�������ǿ��Cl-�Ļ�ԭ�ԣ�С��ͬѧ���������ʵ�顣

ʵ�����Լ�X��________����ͨ��·��ָ�뼸��������ƫת�������Ҳ������еμ�ŨH2SO4��ָ��ƫת����û�б仯��������������еμӵ����ŨH2SO4��ָ������ƫת������Եõ��Ľ�����________��


