题目内容
【题目】常温下,用pH=m的盐酸滴定20mL pH=n的MOH溶液,且m+n=14。混合溶液的pH与盐酸体积V的关系如图所示。下列说法正确的是( )
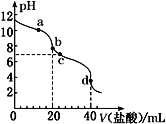
A.a点:c(Cl-)>c(M+)>c(OH-)>c(H+)
B.b点:MOH和HCl恰好完全反应
C.c点:c(H+)=c(OH-)+c(MOH)
D.a点到d点:水电离的c(H+)·c(OH-)先变大,后变小
【答案】D
【解析】
A、在溶液中,根据电荷守恒可得:c(M+)+c(H+)= c(Cl-)+c(OH-),此时溶液仍呈碱性,即c(OH-)>c(H+),故c(M+)>c(Cl-),A错误;
B、b点pH为8,此时盐酸和MOH的溶液体积相同,则说明MOH为弱碱,且此时,MOH和HCl未完全反应,B错误;
C、c点pH为7,则c(H+)=c(OH-),C错误;
D、a点到c点,随着MOH被不断的消耗,其对水的电离的抑制作用逐渐减弱,水电离的c(H+)·c(OH-)逐渐增大;c点到d点,MOH被消耗完全,随着HCl的继续滴加,HCl对水的电离的抑制作用逐渐增强,水电离的c(H+)·c(OH-)逐渐减小;故a点到d点,水电离的c(H+)·c(OH-)先变大,后变小,D正确;
故选D。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】某实验小组想在实验室收集一瓶干燥纯净的氯气,其实验装置及药品如下。

(1)饱和NaCl的作用是________。
(2)氢氧化钠溶液吸收氯气的离子方程式为________。
(3)已知:不同温度下MnO2与盐酸反应的平衡常数
温度t/℃ | 50 | 80 | 110 |
平衡常数K | 3.104×10-4 | 2.347×10-3 | 1.293×10-2 |
MnO2与盐酸的反应是________(填“放热”或“吸热”)。
(4) 实验采用4 mol/L盐酸时,没有产生明显实验现象。小组学生猜测可能是反应速率慢,其原因可能是:________
Ⅰ 反应温度低;Ⅱ盐酸浓度低。
为探究条件对反应速率的影响,小组同学设计并完成以下实验:
序号 | 试剂 | 条件 | 现象 |
实验1 | 4 mol/L盐酸、MnO2 | 加热 | 无明显现象 |
实验2 | 7 mol/L浓盐酸、MnO2 | 不加热 | 无明显现象 |
实验3 | 7 mol/L浓盐酸、MnO2 | 加热 | 产生黄绿色气体 |
① 根据上述实验可知MnO2与盐酸反应产生氯气的条件为________。
② 小组学生进一步猜测:
Ⅰ.盐酸中c(H+)大小影响了反应速率。
Ⅱ.盐酸中c(Cl-) 大小影响了反应速率。
设计实验方案探究该小组学生的猜想。
③ 为探究增大H+浓度,是增强了MnO2的氧化性,还是增强了Cl-的还原性,小组同学设计了如下实验。

实验中试剂X是________。接通电路,指针几乎不发生偏转。若向右侧容器中滴加浓H2SO4,指针偏转几乎没有变化;若向左侧容器中滴加等体积浓H2SO4,指针向左偏转。则可以得到的结论是________。
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)准确称取5.0g烧碱样品,所用主要仪器有药匙、烧杯、___。
(2)将样品配成250mL待测液需要的仪器有烧杯、玻璃棒、胶头滴管、___。
(3)取10.00mL待测液,用___量取。
(4)用0.2000mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___,直到滴定达到终点。
滴定次数 | 待测液的体积/mL | 标准盐酸体积 | |
滴定前读数/mL | 滴定后读数/mL | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)根据上述各数据,计算烧碱的纯度:___。