题目内容
【题目】氨是化肥工业和基本有机化工的主要原料,工业采用N2和H2合成氨的催化过程如下图所示。已知合成氨的反应为放热反应,下列说法正确的是
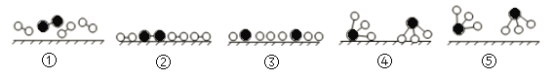
A.使用催化剂可改变反应的△H
B.过程③到④形成N—H吸收能量
C.升高温度,合成氨反应的平衡常数减小
D.催化剂可有效提高反应物的平衡转化率
【答案】C
【解析】
合成氨中催化剂在反应中参与反应历程,降低反应的活化能,加快反应速率,但是不改变反应热、不改变平衡转化率;反应中新化学键的形成释放能量;因为合成氨的反应为放热反应,温度越高,平衡常数越小。
A.催化剂能降低反应的活化能,但是不改变反应的△H,A错误;
B.过程③到④形成N—H释放能量,B错误;
C.合成氨反应是一个放热反应,温度越高,合成氨反应的平衡常数减小,C正确;
D.催化剂能加快化学反应速率,缩短达到平衡的时间,但是不能改变反应物的平衡转化率,D错误;
答案选C。

【题目】某实验小组想在实验室收集一瓶干燥纯净的氯气,其实验装置及药品如下。

(1)饱和NaCl的作用是________。
(2)氢氧化钠溶液吸收氯气的离子方程式为________。
(3)已知:不同温度下MnO2与盐酸反应的平衡常数
温度t/℃ | 50 | 80 | 110 |
平衡常数K | 3.104×10-4 | 2.347×10-3 | 1.293×10-2 |
MnO2与盐酸的反应是________(填“放热”或“吸热”)。
(4) 实验采用4 mol/L盐酸时,没有产生明显实验现象。小组学生猜测可能是反应速率慢,其原因可能是:________
Ⅰ 反应温度低;Ⅱ盐酸浓度低。
为探究条件对反应速率的影响,小组同学设计并完成以下实验:
序号 | 试剂 | 条件 | 现象 |
实验1 | 4 mol/L盐酸、MnO2 | 加热 | 无明显现象 |
实验2 | 7 mol/L浓盐酸、MnO2 | 不加热 | 无明显现象 |
实验3 | 7 mol/L浓盐酸、MnO2 | 加热 | 产生黄绿色气体 |
① 根据上述实验可知MnO2与盐酸反应产生氯气的条件为________。
② 小组学生进一步猜测:
Ⅰ.盐酸中c(H+)大小影响了反应速率。
Ⅱ.盐酸中c(Cl-) 大小影响了反应速率。
设计实验方案探究该小组学生的猜想。
③ 为探究增大H+浓度,是增强了MnO2的氧化性,还是增强了Cl-的还原性,小组同学设计了如下实验。

实验中试剂X是________。接通电路,指针几乎不发生偏转。若向右侧容器中滴加浓H2SO4,指针偏转几乎没有变化;若向左侧容器中滴加等体积浓H2SO4,指针向左偏转。则可以得到的结论是________。