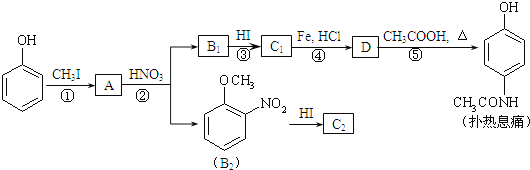
题目内容
【题目】(1)已知在常温常压下:
①CH3CH2OH(l)+3O2(g)![]() 2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44kJ·mol-1
④CH3CH2OH(l)+2O2(g)![]() 2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
则 CO的燃烧热 ΔH =_________。
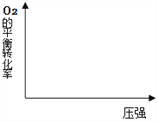
在图中画出,不同温度下(T1>T2),上述反应④中O2的平衡转化率随压强变化的关系图(请在图上标注温度T1、T2)。_________
(3)一定条件下,在体积为3 L的密闭容器中反应CO(g) + 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
①反应的平衡常数表达式K=__________;根据下图,升高温度,K值将___________(填“增大”、“减小”或“不变”)。

②500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是________。
③X点与Y点的平均速率:v(X)_________v(Y);其中X点的正反应速率v正(X)与Z点的逆反应速率v逆(Z)的大小关系为v正(X)________v逆(Z)(填“>”、“<”、“=”)。
④300℃时能够说明该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH) = v生成(H2) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度相等
⑤500℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是___________。(填字母)
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的百分含量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
【答案】-283kJ·mol-1
![]() 减小0.05mol·L-1·min-1<>ccd
减小0.05mol·L-1·min-1<>ccd
【解析】(1)根据盖斯定律可知反应②可以由①+③×3-④得到,即ΔH2=ΔH1+ΔH3×3-ΔH4=(-1366kJ·mol-1)+(-44kJ·mol-1)×3-(-932kJ·mol-1)=-566kJ·mol-1,则 则 CO的燃烧热 ΔH =![]() ΔH2=-283kJ·mol-1 ;
ΔH2=-283kJ·mol-1 ;
(2)反应④中O2的平衡转化率随温度升高而降低,因反应体系反应前后气体的总物质的量不变,压强改变平衡不移动,O2的平衡转化率也不变,则变化图象为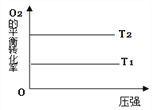 ;
;
(3)①化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,反应物的生成物都是气体,故平衡常数表达式为K=![]() ,由图象可知升高温度乙醇的物质的量减少,平衡向逆反应方向移动,K减小;
,由图象可知升高温度乙醇的物质的量减少,平衡向逆反应方向移动,K减小;
②υ(CH3OH)=(0.3mol÷3L)÷4min=0.025mol/(L.min),故υ(H2)=2υ(CH3OH)=0.05 mol/(L.min);根据图像可知X点与Y点平均速率是v(X)<v(Y);在相同温度下,随着反应的进行X点生成物浓度大,反应速率快,即v正(X)>v逆(Z);
③达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变,在体积不变时,气体的密度不变,不能作为判断是否达到平衡状态的依据,但CO、H2、CH3OH的浓度相等时反应不一定是平衡状态,故答案为c;
④将容器的容积压缩到原来的![]() ,压强增大,正逆反应速率都增大,平衡向正反应方向移动,CH3OH的物质的量增加,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,故有c(H2)/c(CH3OH)减小,故答案为c、d。
,压强增大,正逆反应速率都增大,平衡向正反应方向移动,CH3OH的物质的量增加,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,故有c(H2)/c(CH3OH)减小,故答案为c、d。