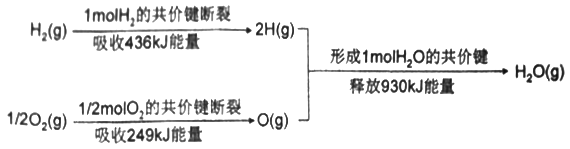
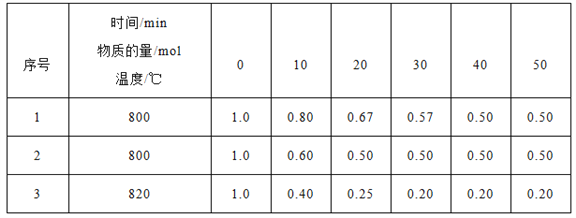
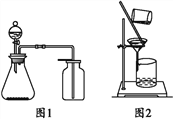
题目内容
【题目】用下列装置进行相应实验,能达到实验目的的是
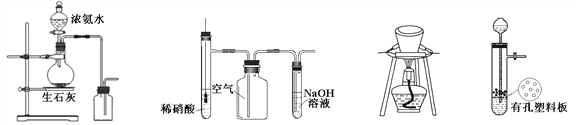
图1 图2 图3 图4
A. 图1所示装置制取并收集氨气
B. 图2所示装置用于制备并收集NO气体
C. 图3所示装置用于除去碳酸氢钠固体中的少量碳酸钠
D. 图4所示装置用于Na2CO3和稀H2SO4反应制取少量的CO2气体
【答案】A
【解析】A浓氨水滴到生石灰中后,CaO与水反应消耗水,同时释放热量,且生成的碱性溶液可以降低NH3的溶解度,这些都能够促使浓氨水更进一步挥发出NH3,右侧为向下排空气法收集NH3,所以A正确。B制取NO方法可行,但是收集方法错误,排空气法收集NO时,NO与O2反应生成NO2,所以B错误。C除去碳酸氢钠固体中的少量碳酸钠时,分解被除去的是碳酸氢钠,除杂方案选择错误,所以C错误。D由于碳酸钠易溶于水,置于隔板上的碳酸钠在加入稀硫酸后很快溶解,使得反应无法控制,所以D错误。正确答案选A

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目