题目内容
【题目】(10分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:

(1)T的原子结构示意图为 。
(2)元素的非金属性(原子的得电子能力):Q W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
【答案】(每空2分,共10分)
(1) (2)弱于 (3)S+2H2SO4(浓)
(2)弱于 (3)S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
(4)2H2O2![]() 2H2O+O2↑; (5)NaNO2。
2H2O+O2↑; (5)NaNO2。
【解析】试题分析:T所处的周期序数与主族序数相等,则T是Al元素,根据元素的位置关系可确定:Q是C;R是N,W是S. (1)T的原子核外电子排布是2、8、3,所以原子结构示意图为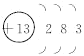 。(2)元素的非金属性越强,得到电子的能力越强,最高价含氧酸的酸性越强。根据酸性H2SO4>H2CO3,可确定元素的非金属性:Q<W;(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,则根据电子守恒、原子守恒,可得该反应的化学方程式为S+2H2SO4(浓)
。(2)元素的非金属性越强,得到电子的能力越强,最高价含氧酸的酸性越强。根据酸性H2SO4>H2CO3,可确定元素的非金属性:Q<W;(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,则根据电子守恒、原子守恒,可得该反应的化学方程式为S+2H2SO4(浓)![]() 3SO2↑+2H2O。(4)原子序数比R多1的元素是O,O的一种氢化物能分解为它的另一种氢化物,该分解反应的化学方程式是2H2O2
3SO2↑+2H2O。(4)原子序数比R多1的元素是O,O的一种氢化物能分解为它的另一种氢化物,该分解反应的化学方程式是2H2O2![]() 2H2O+O2↑;(5)R有多种氧化物,其中甲的相对分子质量最小为NO,在一定条件下,2 L的甲气体与0.5 L的氧气相混合,会发生反应:2NO+O2=2NO2,V(O2)=" 0.5" L,反应消耗V(NO)=1L,产生V(NO2)=1L,则反应后气体为NO、NO2等物质的量的混合气体。若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则发生反应为:NO+NO2+2NaOH=2NaNO2+H2O,所生成R的含氧酸盐化学式是NaNO2。
2H2O+O2↑;(5)R有多种氧化物,其中甲的相对分子质量最小为NO,在一定条件下,2 L的甲气体与0.5 L的氧气相混合,会发生反应:2NO+O2=2NO2,V(O2)=" 0.5" L,反应消耗V(NO)=1L,产生V(NO2)=1L,则反应后气体为NO、NO2等物质的量的混合气体。若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则发生反应为:NO+NO2+2NaOH=2NaNO2+H2O,所生成R的含氧酸盐化学式是NaNO2。