题目内容
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
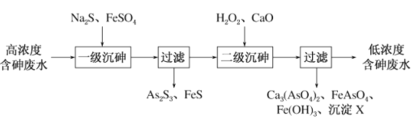
已知:①As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)2![]() (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
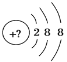
(1)砷在元素周期表中的位置为_______;AsH3的电子式为______;
(2)下列说法正确的是_________;
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.第一电离能:S<P<As
(3)沉淀X为__________(填化学式);
(4)“一级沉砷”中FeSO4的作用是________。
(5)“二级沉砷”中H2O2与含砷物质反应的化学方程式为__________;
(6)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成![]() ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
【答案】第四周期第VA族 ![]() a CaSO4 沉淀过量的S2-,使As2S3(s)+3S2-(aq)2
a CaSO4 沉淀过量的S2-,使As2S3(s)+3S2-(aq)2![]() (aq)平衡逆向移动,使一级沉砷更完全 H3AsO3+H2O2= H3AsO4+H2O 4FeS2+15O2+14H2O=4Fe(OH)3+8
(aq)平衡逆向移动,使一级沉砷更完全 H3AsO3+H2O2= H3AsO4+H2O 4FeS2+15O2+14H2O=4Fe(OH)3+8![]() +16H+
+16H+
【解析】
废水中砷元素主要以亚砷酸(H3AsO3)形式存在,加入硫化钠生成As2S3沉淀,为防止As2S3与硫离子反应再次溶解,所以再加入硫酸亚铁除去过量的硫离子,过滤得到As2S3和FeS,滤液中加入过氧化氢将亚砷酸氧化成砷酸,亚铁离子氧化成铁离子,再加入CaO沉淀砷酸根、铁离子、硫酸根,得到Ca2(AsO4)2、FeAsO4、Fe(OH)3、CaSO4沉淀和低浓度含砷废水。
(1)As元素为33号元素,与N元素同主族,位于第四周期第VA族;AsH3和氨气分子结构相同为共价化合物,砷原子和三个氢原子形成三个As-H键,电子式为:![]() ;
;
(2)a.同周期主族元素自左而右非金属性增强,最高价氧化物对应水化物酸性增强,同主族自上而下非金属性减弱,最高价氧化物对应水化物酸性减弱,酸性:H2SO4>H3PO4>H3AsO4,故a正确;
b.同周期主族元素自左而右原子半径减小,同主族自上而下原子半径依次增大,原子半径:As>P>S,故b错误;
c.同主族元素自上而下第一电离能减小,P和S同周期,但是P原子3p能级为半满状态,更稳定,第一电离能更大,所以第一电离能P>S>As,故c错误;
综上所述选a;
(3)根据分析可知沉淀为微溶物CaSO4;
(4)As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)2![]() (aq),所以需要加入FeSO4除去过量的硫离子,使平衡逆向移动,一级沉砷更完全;
(aq),所以需要加入FeSO4除去过量的硫离子,使平衡逆向移动,一级沉砷更完全;
(5)含砷物质物质为H3AsO3,加入过氧化氢可以将其氧化成H3AsO4,根据电子守恒和元素守恒可得化学方程式为H3AsO3+H2O2= H3AsO4+H2O;
(6)根据题意可知FeS2被O2氧化生成Fe(OH)3、![]() ,根据元素守恒可知反应物应该还有H2O,FeS2整体化合价升高15价,一个O2降低4价,所以二者的系数比为4:15,再根据元素守恒可得离子方程式为4FeS2+15O2+14H2O=4Fe(OH)3+8
,根据元素守恒可知反应物应该还有H2O,FeS2整体化合价升高15价,一个O2降低4价,所以二者的系数比为4:15,再根据元素守恒可得离子方程式为4FeS2+15O2+14H2O=4Fe(OH)3+8![]() +16H+。
+16H+。

 新课标阶梯阅读训练系列答案
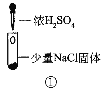
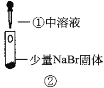
新课标阶梯阅读训练系列答案【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟。 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝。 | 溶液变深紫色;经检验溶液含单质碘。 |
下列对实验的分析合理的是
A.实验1中,白烟是(NH4)2SO4
B.根据实验1和实验2判断还原性:Br->Cl-
C.根据实验3判断还原性:I->Br-
D.上述实验利用了浓H2SO4的强酸性、强氧化性等性质