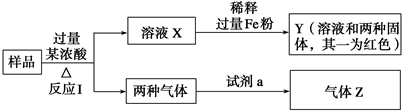
题目内容
1.磷矿石主要以碳酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3]等形式存在.目前国际上磷矿石利用大致有湿法磷酸和热法磷酸两种工艺.其中湿法磷酸是指磷酸矿石用过量硫酸分解制备磷酸.热法磷酸指用过量焦炭、二氧化硅与磷灰石在高温下获得单质磷,然后再由磷制备磷酸.部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(2)热法生产磷酸反应过程中产生大量炉渣和尾气,其中炉渣的主要成分是:CaSiO3(填化学式).尾气中主要含有SiF4、CO(均填化学式).还含有少量PH3、H2S和HF等.将其通入纯碱溶液中可除去气体SiF4、H2S和HF,再通入NaClO溶液可除去具有还原性的PH3气体,写出该反应的离子方程式2PH3+3ClO-=2P+3Cl-+3H2O.
分析 (1)Ca5F(PO4)3可以看作磷酸钙、氟化钙的混合物,与过量浓硫酸反应生成磷酸、磷酸钙与HF;
根据P元素守恒可得关系式P2O5~2H3PO4,依据此关系式计算;
(2)热法磷酸指用过量焦炭、二氧化硅与磷灰石在高温下获得单质磷,再由磷制备磷酸,第一步还生成硅酸钙与SiF4及CO;尾气应纯碱溶液处理后,再通入NaClO溶液可除去具有还原性的PH3气,反应生成P、NaCl与水.
解答 解:(1)Ca5F(PO4)3可以看作磷酸钙、氟化钙的混合物,与过量浓硫酸反应生成磷酸、磷酸钙与HF,反应方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;
设制得到70%的商品磷酸xt,则:
P2O5~~~2 H3PO4
142 196
1t×30% 70%x t
则142:196=1t:70%x t
解得x=0.59t,
故答案为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;0.59;
(2)热法磷酸指用过量焦炭、二氧化硅与磷灰石在高温下获得单质磷,再由磷制备磷酸,第一步还生成硅酸钙与SiF4及CO,炉渣的主要成分是:CaSiO3.尾气中主要含有SiF4、CO,
尾气应纯碱溶液处理后,再通入NaClO溶液可除去具有还原性的PH3气,反应生成P、NaCl与水,反应离子方程式为:2PH3+3ClO-=2P+3Cl-+3H2O,
故答案为:CaSiO3;SiF4、CO;2PH3+3ClO-=2P+3Cl-+3H2O.
点评 本题是对化学与技术的考查,涉及化学计算、化学方程式书写、对信息的提取应用,是对学生综合能力的考查,难度较大.

练习册系列答案
相关题目
12.2009年12月哥本哈根气候变化会议的重要议题是减缓温室气体排除,“节能减排”是达到该目标的必经之路.下列措施无助于节能减排的是( )
| A. | 将白炽灯换成节能灯 | B. | 少开汽车,多骑自行车或坐公交车 | ||
| C. | 用风力发电代替火力发电 | D. | 把高耗能产业转移到欠发达地区 |
9.如表中评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 铁与稀盐酸反应: 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| B | 大理石溶于醋酸的反应: CaCO3+2H+═Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | FeCl3溶液“腐蚀”铜箔: Fe3++Cu═Fe2++Cu2+ | 正确 |
| D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | 错误,HCO3-也可以与OH-反应 |
| A. | A | B. | B | C. | C | D. | D |
16.某有机物的结构简式如图所示,下列关于该有机物的叙述正确的是( )
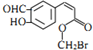

| A. | 该有机物含有六种官能团 | |
| B. | 该有机物属于芳香烃 | |
| C. | 该有机物可发生取代、加成、加聚、氧化、还原、削去反应 | |
| D. | 1 mol该有机物在适当条件下,最多可与5 molH2反应 |
6.短周期元素X、Y、Z的原子序数依次递增,它们的原子最外层电子数之和为11,X、Z同主族,Y原子最外层电子数比X原子次外层电子数多1.下列叙述正确的是( )
| A. | Y的最高价氧化物的熔点比X的最高价氧化物的熔点低 | |
| B. | 原子半径:Y>Z>X | |
| C. | Y的最高价氧化物的水化物只能与酸反应,不能与碱反应 | |
| D. | 由Z、Y两元素分别形成的单质均存在同素异形体 |
13.下列说法不正确的是( )
| A. | 乙醇和乙酸均可与钠反应放出氢气 | |
| B. | 乙烯和苯均能使溴水褪色,且原理相同 | |
| C. | 等物质的量的正丁烷和异丁烷,含有非极性键的数目相同 | |
| D. | 甲烷在光照条件下与Cl2发生取代反应,共得到5种产物 |
10.下列冶炼金属的原理及方程式不正确的是( )
| A. | 工业冶炼铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| B. | 火法炼铜Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | |
| C. | 工业冶炼镁MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2 | |
| D. | 工业冶炼铝Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al |
11.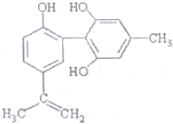 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| B. | 滴入酸性KMnO,溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 该物质的分子式为C14H28O3 | |
| D. | lmol该物质分别与浓溴水和H2反应时,最多消耗Br3和H2分别为4mol和7mol |