题目内容
11.由Fe2O3、CuO、C组成的混合粉末,取样品进行下列实验(部分产物略去):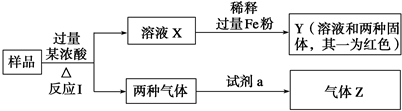
(1)将Y过滤:
①滤渣中两种固体为Cu、Fe(填化学式).
②若向滤液中通入氯气,反应的离子方程式是2Fe2++Cl2=2Cl-+2Fe3+.
③若向滤液中加入NaOH溶液,搅拌,反应的方程式有两个(是离子反应的写离子方程式)分别为:Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②若Z为两种气体,试剂a为适量水,则Z中两种气体的化学式是CO2、NO.
分析 Fe2O3、CuO、C组成的混合粉末溶于过量某浓酸中,发生的离子反应为Fe2O3+6H+=2Fe3++3H2O、CuO+2H+=Cu2++H2O,溶液X中加入过量Fe粉,Fe能氧化铜离子生成Cu,所以得到的固体中一种为红色,另一种为过量的Fe,发生离子反应有2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu;
能和C加热生成两种气体的浓酸有浓硫酸、浓硝酸,样品和浓酸反应生成的两种气体和试剂a反应时,如果Z为一种气体,且试剂a是饱和NaHCO3溶液,则气体Z只能是CO2,SO2和碳酸氢钠反应而消耗生成CO2;
如果Z是两种气体,且a是水,则酸是浓硝酸,浓硝酸和C反应生成CO2、NO2、NO2和水反应生成硝酸和NO,
再结合题目分析解答.
解答 解:Fe2O3、CuO、C组成的混合粉末溶于过量某浓酸中,发生的离子反应为Fe2O3+6H+=2Fe3++3H2O、CuO+2H+=Cu2++H2O,溶液X中加入过量Fe粉,Fe能氧化铜离子生成Cu,所以得到的固体中一种为红色,另一种为过量的Fe,发生离子反应有2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu;
能和C加热生成两种气体的浓酸有浓硫酸、浓硝酸,样品和浓酸反应生成的两种气体和试剂a反应时,如果Z为一种气体,且试剂a是饱和NaHCO3溶液,则气体Z只能是CO2,SO2和碳酸氢钠反应而消耗生成CO2;
如果Z是两种气体,且a是水,则酸是浓硝酸,浓硝酸和C反应生成CO2、NO2、NO2和水反应生成硝酸和NO,
(1)将Y过滤:
①通过以上分析知,滤渣中两种固体为Cu、Fe,故答案为:Cu;Fe;
②若向滤液中通入氯气,亚铁离子和氯气发生氧化还原反应生成铁离子和氯离子,反应的离子方程式是 2Fe2++Cl2=2Cl-+2Fe3+,
故答案为:2Fe2++Cl2=2Cl-+2Fe3+;
③若向滤液中加入NaOH溶液,搅拌,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,但氢氧化亚铁不稳定,易被氧气氧化生成氢氧化铁,所以反应的方程式有两个(是离子反应的写离子方程式)分别为:
Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,SO2和碳酸氢钠反应而消耗生成CO2,气体Z只能是CO2,浓酸是浓硫酸,则反应I中能同时生成两种气体的化学方程式是
C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②若Z为两种气体,试剂a为适量水,则酸是浓硝酸,浓硝酸和C反应生成CO2、NO2、NO2和水反应生成硝酸和NO,所以Z中两种气体的化学式是NO、CO2,
故答案为:CO2;NO.
点评 本题考查物质的分离和提纯及无机物推断等知识点,侧重考查元素化合物知识,明确物质的性质是解本题关键,知道离子方程式书写规则,注意氢氧化亚铁的不稳定性,题目难度不大.

| A. | 3:1 | B. | 3:2 | C. | 2:1 | D. | 1:2 |
| A. | 增加SO2的浓度 | B. | 充入一定量惰性气体 | ||
| C. | 升高温度 | D. | 使用催化剂 |
| A. | 改变外界条件使化学平衡状态改变时,平衡常数也一定改变 | |
| B. | 改变条件,反应物的转化率增大,平衡常数一定增大 | |
| C. | 若一个可逆反应的平衡常数很大,则反应会在较短的时间内完成 | |
| D. | 已知2NO2?N2O4正反应的平衡常数为K1,逆反应的平衡常数为K2,则K1=$\frac{1}{{K}_{2}}$ |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
| A. | 蒸馏 | B. | 分馏 | C. | 重结晶 | D. | 萃取 |
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(2)热法生产磷酸反应过程中产生大量炉渣和尾气,其中炉渣的主要成分是:CaSiO3(填化学式).尾气中主要含有SiF4、CO(均填化学式).还含有少量PH3、H2S和HF等.将其通入纯碱溶液中可除去气体SiF4、H2S和HF,再通入NaClO溶液可除去具有还原性的PH3气体,写出该反应的离子方程式2PH3+3ClO-=2P+3Cl-+3H2O.
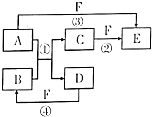 已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)
已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出) .
.