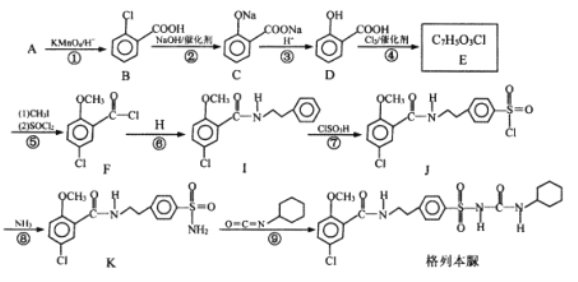
题目内容
【题目】按如图进行实验,探究H2O2的分解反应。
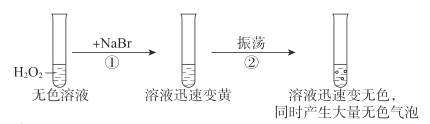
下列说法不正确的是( )
A.NaBr中的Br-加快了H2O2分解速率
B.双氧水既发生了氧化反应,又发生了还原反应
C.反应②的离子方程式是Br2+H2O2=2Br-+2H++O2↑
D.1molH2O2发生分解反应时,转移电子的物质的量是2mol
【答案】D
【解析】
A.由题意和实验现象可知,首先过氧化氢把溴离子氧化生成溴单质,而后溴单质又被还原成为溴离子,过程中放出氧气速率加快,反应前后溴离子没有变化,因此溴离子加快了过氧化氢的分解速率,起到了催化剂的作用,故A正确;
B.由A的分析可知,①中过氧化氢发生了还原反应,②中过氧化氢发生了氧化反应,故B正确;
C.由A分析可知,反应②为溴单质氧化过氧化氢生成氧气自身被还原成溴离子的过程,方程式正确,故C正确;
D.由以上分析可知,过氧化氢分解的总反应为:![]() ,2mol过氧化氢分解,转移2mol电子,故D错误;
,2mol过氧化氢分解,转移2mol电子,故D错误;
答案选D。

【题目】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_____(填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因_____。
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO![]() +NO
+NO![]() +_____=Mn2++NO
+_____=Mn2++NO![]() +H2O。
+H2O。
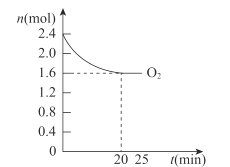
(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
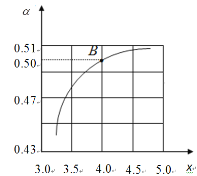
其它条件不变时,α随着x/span>增大而增大的原因是____;图中的B点处NH3的平衡转化率为____。
II.(4)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为________。
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=___(用n表示)。
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成__沉淀(填化学式);当测得溶液中钙离子沉淀完全(浓度小于10-5 mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c = ______mol·L-1。(已知:Ksp[Mg3(PO4)2] =6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。)