题目内容
11.有0.3mol的BaSO4沉淀,每次用1L 1.7mol/L的Na2CO3处理,若使BaSO4中SO42-全部转化在溶液中,需反复洗3次.(ksp(BaSO4)=1.07×10-10 ksp(BaCO3)=2.58×10-9)分析 反应的发生为BaSO4 +CO32-=BaCO3 +SO42,K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{1.07×1{0}^{-10}}{2.58×1{0}^{-9}}$=0.042,结合平衡常数计算该题.
解答 解:设每次用1.00L 2.0 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(2.0-x)mol•L-1 x mol•L-1
根据K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{x}{2.0-x}$=$\frac{1.07×1{0}^{-10}}{2.58×1{0}^{-9}}$=0.042,
解得:x=0.081,处理次数=$\frac{0.2mol}{0.081mol}$=2.5,所以至少处理3次,
故答案为:3.
点评 本题考查了难溶电解质的溶解平衡,为高频考点,侧重于学生的分析、计算能力的考查,结合溶度积常数来分析解答,注意平衡常数的运用,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列推断正确的是( )
| A. | 硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 加碘食盐中加入的是碘单质,可防止甲状腺肿大疾病 | |
| D. | 要除去衣服上的顽固污渍,均可将衣服泡在漂白液中 |
19. 在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )
在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )
 在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )
在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )| A. | 4 min内 v(Z)=0.025 mol•L-1•min-1 | |
| B. | Y的平衡转化率为75% | |
| C. | 平衡常数K=(25/12)(mol•L-1)-2 | |
| D. | t1 min时充入少量He,平衡向正向移动 |
6.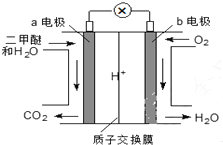 二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )
 二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上反应为O2+2H2O+4e-=4OH- | |
| C. | 电池工作时,若a电极上有1molCH3OCH3放电,电路中有12mol电子转移 | |
| D. | 电池工作时,电池内部H+从a电极移向b电极 |
16.下列微粒可以大量共存于同一溶液中的是( )
| A. | Na+、NH4+、AlO2-、SiO32- | B. | Ca2+、NH4+、NH3﹒H2O、CH3COO- | ||
| C. | Cr2O72-、H+、C2H5OH、NO3- | D. | Cu2+、SO42-、HS-、Cl- |
20.用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )

| A. | 放电时,OH-向镍电极作定向移动 | |
| B. | 放电时,负极的电极反应为:H2-2e-+2OH-═2H2O | |
| C. | 充电时,将电池的碳电极与外电源的正极相连 | |
| D. | 充电时,阴极的电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
18.下列关于乙酸性质的叙述中,正确的是( )
| A. | 乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体 | |
| B. | 乙酸具有氧化性,它能被氧化成乙醛 | |
| C. | 乙酸分子中含有碳氧双键,所以它能使溴水褪色 | |
| D. | 可利用酯化反应,分离提纯乙酸 |

