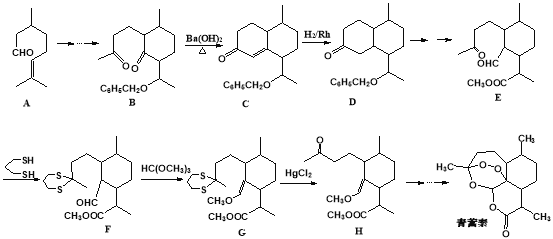
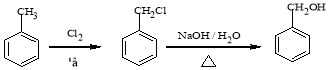
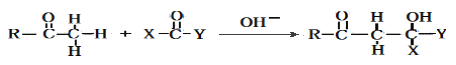题目内容
【题目】下图为元素周期表的一部分,请根据元素①-⑧在表中的位置,用化学用语回答下列问题:
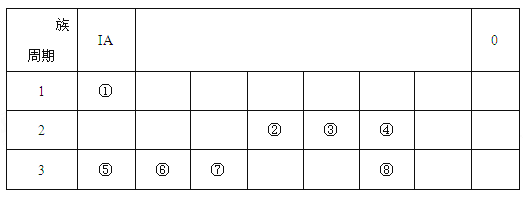
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是 (用化学式表示,下同);碱性最强的是 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序是 (用离子符号表示)。
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有: 。
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族) 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
![]()
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行。B的化学式为 。对应的反应①的离子方程式为 。
【答案】(1)HNO3H2SO4;NaOH (2)O2->Na+>Mg2+
(3)离子键、共价键(4)2Mg+CO2![]() C+2MgO或Mg+H2SO4=MgSO4+H2↑(其它合理答案同样得分)(5)Al(OH)3 Al3++3OH-=Al(OH)3↓或【Al(OH)4】-+H+=Al(OH)3↓+H2O
C+2MgO或Mg+H2SO4=MgSO4+H2↑(其它合理答案同样得分)(5)Al(OH)3 Al3++3OH-=Al(OH)3↓或【Al(OH)4】-+H+=Al(OH)3↓+H2O
【解析】试题分析:根据元素①-⑧在表中的位置可判断,它们分别是H、C、N、O、Na、Mg、Al、S。
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是HNO3H2SO4,碱性最强的是NaOH。
(2)④、⑤、⑥的简单离子的核外电子排布相同,其离子半径随原子序数的增大而减小,则半径由大到小的顺序是O2->Na+>Mg2+。
(3)由①、④、⑤、三种元素组成的化合物是氢氧化钠,其中化学键的类型有离子键、共价键。
(4)根据元素可知能发生的置换反应有2Mg+CO2![]() C+2MgO或Mg+H2SO4=MgSO4+H2↑。
C+2MgO或Mg+H2SO4=MgSO4+H2↑。
(5)若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行,则该金属应该是Al,B是氢氧化铝,其化学式为Al(OH)3。A可能是铝盐或偏铝酸盐,则对应的反应①的离子方程式为Al3++3OH-=Al(OH)3↓或【Al(OH)4】-+H+=Al(OH)3↓+H2O。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案