题目内容
【题目】某化学小组为探究草酸的性质并制备草酸钠及其用途,查阅到如下信息:

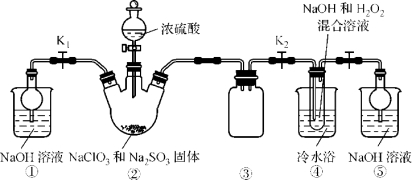
探究草酸部分性质并制备草酸钠的生产流程如下:
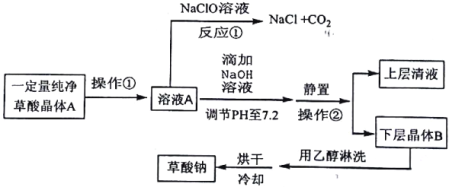
请回答下列问题:
(1)写出反应①的化学方程式__________。表明草酸具有__________性。
(2)向溶液A中加入NaOH溶液,开始滴加速度要尽量快些.其目的是__________。该反应达到终点时的化学方程式为__________。
(3)操作②的名称是__________。用乙醇淋洗晶体B的目的是__________
(4)用0.01000mol/L的高锰酸钾溶液滴定25.00mL某浓度的草酸钠溶液时.需要加入适量的稀硫酸,所发生反应为:5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O,若硫酸加入太多,结果会__________:操作中需用__________滴定管(填“酸式”或“碱式”),当达到反应终点时的现象是__________;测得此时消耗上述高锰酸钾溶液20.00mL,则该草酸钠溶液浓度为__________mol/L。
【答案】(1)H2C2O4+NaC1O=NaC1+2CO2↑+H2O;还原
(2)利用中和反应放热,升温促进反应(或增大反应速率);H2C2O4+2NaOH=Na2C2O4↓+2H2O
(3)过滤;除去晶体表面水分减少损失
(4)草酸根会生成草酸氢根和草酸,使溶液中草酸根离子浓度降低,减慢反应速率;酸式滴定管;溶液呈现浅紫色且30s内不褪色;0.0200mol/L
【解析】
试题分析:(1)反应①是次氯酸钠将草酸氧化的过程,反应的化学方程式为H2C2O4+NaC1O=NaC1+2CO2↑+H2O,表明草酸具有还原性,故答案为:H2C2O4+NaC1O=NaC1+2CO2↑+H2O;还原
(2)向溶液A中加入NaOH溶液,发生中和反应,开始滴加速度要尽量快些,可以利用中和反应放热,升温促进反应(或增大反应速率),生成的草酸钠微溶于水,反应达到终点时的化学方程式为H2C2O4+2NaOH=Na2C2O4↓+2H2O,故答案为:利用中和反应放热,升温促进反应(或增大反应速率);H2C2O4+2NaOH=Na2C2O4↓+2H2O
(3) 生成的草酸钠微溶于水,形成沉淀,操作②为过滤。用乙醇淋洗晶体B可以除去晶体表面水分,同时防止洗涤时草酸钠的损失,故答案为:过滤;除去晶体表面水分减少损失
(4)用高锰酸钾溶液滴定草酸钠溶液时发生反应5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O,若硫酸加入太多,草酸根会生成草酸氢根和草酸,使溶液中草酸根离子浓度降低,减慢反应速率;高锰酸钾溶液检验腐蚀性,能够腐蚀乳胶管,操作中应选用酸式滴定管,当达到反应终点时溶液呈现浅紫色且30s内不褪色;n(Na2C2O4)=![]() n(MnO4-)=
n(MnO4-)=![]() ×0.01000mol/L×0.0200L=0.0005mol,c(Na2C2O4)=
×0.01000mol/L×0.0200L=0.0005mol,c(Na2C2O4)=![]() = 0.0200mol/L,故答案为:草酸根会生成草酸氢根和草酸,使溶液中草酸根离子浓度降低,减慢反应速率;酸式滴定管;溶液呈现浅紫色且30s内不褪色;0.0200mol/L。
= 0.0200mol/L,故答案为:草酸根会生成草酸氢根和草酸,使溶液中草酸根离子浓度降低,减慢反应速率;酸式滴定管;溶液呈现浅紫色且30s内不褪色;0.0200mol/L。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
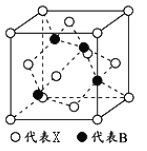
双基同步导航训练系列答案【题目】[化学—选修3:物质结构与性质] 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用。
(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中1/3的Cu以罕见的Cu3+形式存在。Cu在元素周期表中的位置为____ ,基态Cu3+的核外电子排布式为_ _______。
(2)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合作录音磁带磁粉原料的为____(填选项字母)。
A.V2O5 | B.CrO2 | C.PbO | D.ZnO |
(3)屠呦呦因在抗疟药——青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人。青蒿素的结构简式如图l所示,其组成元素的电负性由大到小的顺序为 ;碳原子的杂化方式有____ 。
(4)“可燃冰”因储量大、污染小被视为未来石油的替代能源,由甲烷和水形成的“可燃冰”结构如图2所示。
①“可燃冰”中分子间存在的2种作用力为 。
②H2O的VSEPR模型为 ,比较键角的大小:H2O CH4(填“>”“<”或“=”),原因为 。
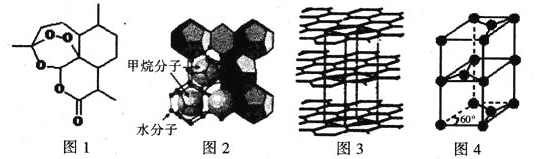
(5)锂离子电池在便携式电子设备以及电动汽车、卫星等领域显示出广阔的应用前景,该电池负极材料为石墨,石墨为层状结构(如图3),其晶胞结构如图4所示,该晶胞中有 个碳原子。已知石墨的层间距为apm,C-C键长为b pm,阿伏伽德罗常数的值为NA,则石墨晶体的密度为 g·cm-3(列出计算式)。