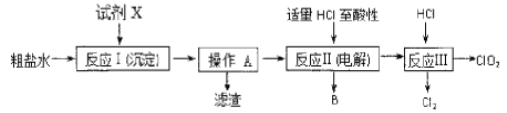
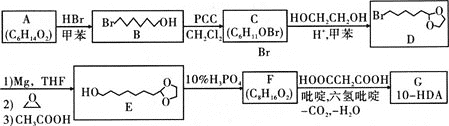
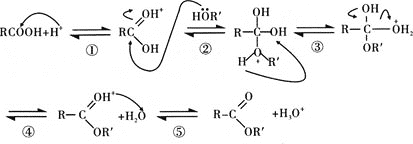
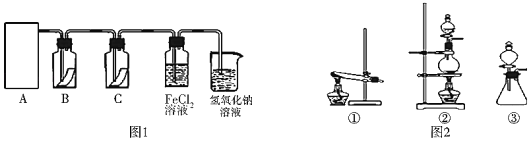
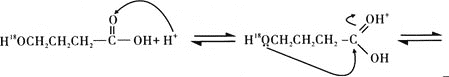题目内容
【题目】已知用甲醇制乙烯、丙烯等烯烃时,在温度为400 ℃时,发生的主反应为2CH3OH![]() C2H4+2H2O、3CH3OH
C2H4+2H2O、3CH3OH![]() C3H6+3H2O,副反应为2CH3OH
C3H6+3H2O,副反应为2CH3OH![]() CH3OCH3+H2O。乙烯和丙烯的选择性(转化的甲醇中生成乙烯和丙烯的百分比)及丙烯对乙烯的比值(Cat.1和Cat.2代表两种等量的催化剂)如图所示,下列说法不正确的是
CH3OCH3+H2O。乙烯和丙烯的选择性(转化的甲醇中生成乙烯和丙烯的百分比)及丙烯对乙烯的比值(Cat.1和Cat.2代表两种等量的催化剂)如图所示,下列说法不正确的是
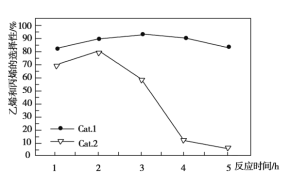
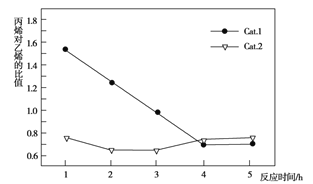
A. 使用Cat.2反应2小时后乙烯和丙烯的选择性下降
B. 使用Cat.1反应3小时后产生的烯烃主要是乙烯
C. 使用Cat.2反应3小时内产生的烯烃主要是丙烯
D. 使用Cat.1时乙烯和丙烯的选择性一直高于使用Cat.2时
【答案】C
【解析】
本题考查图象分析,意在考查考生的分析能力。使用Cat.2反应2小时后生成的副产物二甲醚增多,导致乙烯和丙烯的选择性下降,A正确;使用Cat.1,反应在3小时后,丙烯对乙烯的比值小于1.0,此时产生的烯烃主要是乙烯,B正确;使用Cat.2,反应在3小时内,丙烯对乙烯的比值小于1.0,此时产生的烯烃主要是乙烯,C错误;使用Cat.1时乙烯和丙烯的选择性一直高于使用Cat.2时,D正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目