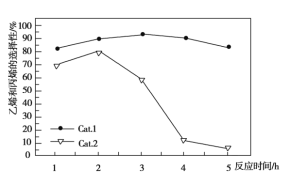
��Ŀ����
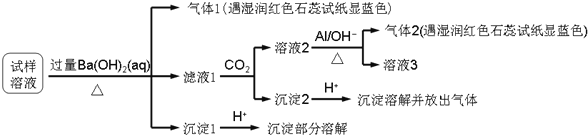
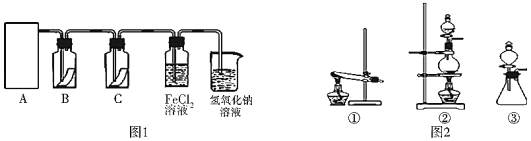
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�á�Ϊ̽�����������ʣ�ijͬѧ�������ͼ1��ʾ��ʵ��װ�á�
��1��ʵ������ȡ�����ķ�Ӧԭ��Ϊ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O���÷�Ӧ�л�ԭ����_____����ԭ������_____
MnCl2+Cl2��+2H2O���÷�Ӧ�л�ԭ����_____����ԭ������_____
��2�����ã�1��������ԭ������ͼ2��ѡ����ʵ�����װ�ã�A������_____����д��ţ���
��3��װ��B��C�����ηŵ��Ǹ���ĺ�ɫ������ʪ��ĺ�ɫ������������װ��_____�еĺ�ɫ������ɫ����ʵ������и�ͬѧ����װ��B��C�еIJ�������ɫ����ԭ�������_____��˵����װ�ô������Ե�ȱ�ݣ�����������ĸĽ�����_____
��4��Ϊ����֤�����������ԣ�������ͨ��FeCl2��Һ�У�д��������FeCl2��Һ��Ӧ�����ӷ���ʽ_____
��5����ҵ�ϳ���ʯ����������������β���Ƶ�Ư�ۣ�Ư�۵���Ч�ɷ���_____���ѧʽ����
���𰸡�HCl MnCl2 �� C Cl2�п��ܻ���������ˮ���� Ӧ����A��B֮������ʢ��ŨH2SO4��ϴ��ƿ����ȥCl2�е�ˮ���� 2Fe2++Cl2��2Fe3++2Cl�� Ca��ClO��2
��������
��1��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O���ݻ�ԭ���ͻ�ԭ����ĸ�����
MnCl2+Cl2��+2H2O���ݻ�ԭ���ͻ�ԭ����ĸ�����
��2��ʵ������ȡ�����ķ�Ӧԭ��Ϊ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��3����Ư�����õ���HClO������ĺ�ɫ�������ܱ�����Ư�ף�˵��Cl2�п��ܻ���������ˮ���������װ�ó�ˮ���ɣ�
��4�������� Fe2+����ΪFe3+����������ԭΪCl����
��5��Ư�۵���Ч�ɷ���Ca(ClO��2��
��1��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��Ӧ����Ԫ�ػ��ϼ۴�+4�۱仯Ϊ+2�ۣ����ϼ۽��ͱ���ԭ�õ���ԭ����MnCl2��HCl����Ԫ�ػ��ϼ���������ԭ����������
MnCl2+Cl2��+2H2O��Ӧ����Ԫ�ػ��ϼ۴�+4�۱仯Ϊ+2�ۣ����ϼ۽��ͱ���ԭ�õ���ԭ����MnCl2��HCl����Ԫ�ػ��ϼ���������ԭ����������
��2��ʵ������ȡ�����ķ�Ӧԭ��Ϊ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O���������Һ���ȷ�Ӧ��������ѡ����װ��Ϊ�ڣ�
MnCl2+Cl2��+2H2O���������Һ���ȷ�Ӧ��������ѡ����װ��Ϊ�ڣ�
��3��װ��B��C�����ηŵ��Ǹ���ĺ�ɫ������ʪ��ĺ�ɫ������������װ��C�еĺ�ɫ������ɫ����ʵ������и�ͬѧ����װ��B��C�еIJ�������ɫ����ԭ������ǣ�Cl2�п��ܻ���������ˮ������˵����װ�ô������Ե�ȱ�ݣ������ĸĽ�������Ӧ����A��B֮������ʢ��ŨH2SO4��ϴ��ƿ����ȥCl2�е�ˮ������
��4�������� Fe2+����ΪFe3+����������ԭΪCl������Ӧ���ӷ���ʽΪ2Fe2++Cl2��2Fe3++2Cl����
��5����ҵ�ϳ���ʯ����������������β���Ƶ�Ư�ۣ�Ư�۵���Ч�ɷ���Ca(ClO��2��

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�