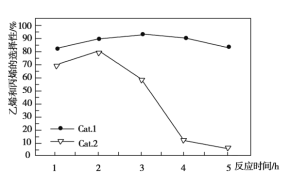
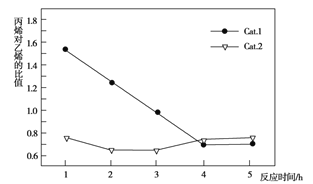
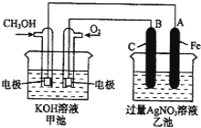
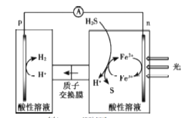
��Ŀ����
����Ŀ���ú��ܷ���(��Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��NiO��SiO2��)�Ʊ������ܾ���(CoC2O4��2H2O)��������ͼ��
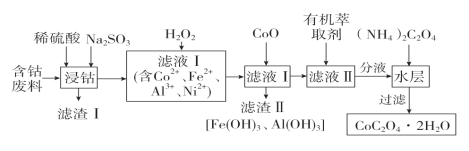
(1)�������ijɷ���________������ʱAl2O3�ܽ�����ӷ���ʽΪ__________________��Co2O3�ܽ�����ӷ���ʽΪ________________________________��
(2)��Һ������H2O2��Ŀ����________________________________________������CoO����Fe(OH)3��Al(OH)3��ԭ����_________________________________________����Ҫ����Һ����Fe3����Al3��ȫ����������Ӧ����Һ����pH������_____________��(��֪����Һ������Ũ��С��1��10��5 mol��L��1������Ϊ������ȫ������Ni(OH)2��Fe(OH)3��Al(OH)3��Ksp�ֱ�Ϊ1��10��15��1��10��38��1��10��32)
(3)�����л���ȡ����Ŀ����_______________________________��
(4)����(NH4)2C2O4��Ӧ�����ӷ���ʽΪ___________________________________��
���𰸡�SiO2 Al2O3+6H+=2 Al3++3H2O Co2O3+SO32-+4H+= 2Co2++ SO32-+2H2O ��Fe2+����ΪFe3+���Ա���������������������ȥ CoO�������ӷ�Ӧ������������Ũ�ȣ���ʹFe3+��Al3+��ˮ��ƽ�������ƶ����Ӷ�����Fe(OH)3��Al(OH)3���� �ܽ�Ni 2����ʹ֮��ˮ����� 5<pH<9 Co2++ C2O42-+2H2O=CoC2O4��2H2O��
��������
���ܷ��ϣ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��NiO��SiO2��������ϡ������������ƣ�Na2SO3��Co3+��Fe3+��ԭΪCo2+��Fe2+���ɵ�CoSO4��FeSO4��Al2(SO4)3��NiSO4��Һ��SiO2�����������Һ�м���H2O2����Fe2+����ΪFe3+������CoO��pH���ɵõ�Fe��OH��3��Al��OH��3���������˺�������Һ��Ҫ����CoSO4��Ni SO4�������л���ȡ������Һ��ˮ������Ҫ����CoSO4������������Һ�õ������ܣ��ݴ˷������
(1) ���ܷ�����ֻ��SiO2�������ᷴӦ���������ijɷ���SiO2������ʱAl2O3�����ᷴӦ������������ˮ��Al2O3�ܽ�����ӷ���ʽΪAl2O3+6H+=2 Al3++3H2O��Co2O3�ܽ�ʱNa2SO3��Co3+��ԭΪCo2+����Ӧ�����ӷ���ʽΪCo2O3+SO32-+4H+= 2Co2++ SO32-+2H2O��
(2)��Һ������H2O2��Ŀ���ǽ�Fe2+����ΪFe3+���Ա���������������������ȥ������CoO�������ӷ�Ӧ������������Ũ�ȣ���ʹFe3+��Al3+��ˮ��ƽ�������ƶ����Ӷ�����Fe(OH)3��Al(OH)3��������Fe3��ȫ������ʱ��c(OH-)>![]() ����ʱ��Һ��pH>3����Al3+ȫ������ʱ��c(OH-)>
����ʱ��Һ��pH>3����Al3+ȫ������ʱ��c(OH-)>![]() ����ʱ��Һ��pH>5����Ni 2��ȫ������ʱ��c(OH-)>
����ʱ��Һ��pH>5����Ni 2��ȫ������ʱ��c(OH-)>![]() ����ʱ��Һ��pH>9������Һ����Fe3����Al3��ȫ����������Ӧ����Һ����pH������5<pH<9��
����ʱ��Һ��pH>9������Һ����Fe3����Al3��ȫ����������Ӧ����Һ����pH������5<pH<9��
(3)�����л���ȡ����Ŀ������ȡNi 2����ʹ֮��ˮ����롣
(4)����(NH4)2C2O4����CoC2O4��H2O��������Ӧ�����ӷ���ʽ��Co2++ C2O42-+2H2O=CoC2O4��2H2O��