题目内容
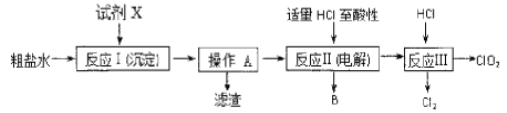
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产C1O2的工艺主要包括:①粗盐精制;②电解微酸性NaC1溶液;③C1O2的制取。工艺流程如下图:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、![]() 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________(填化学式)。
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________(填化学式)。
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成C1O2。反应Ⅲ的化学方程式为______________。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+==I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:![]() )
)
①准确量取10.00 mL ClO2溶液的玻璃仪器是__________________。
②上述步骤3中滴定终点的现象是__________________________。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_________(填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原C1O2溶液的浓度为_________mol·L-1(用含字母的代数式表示)。
【答案】NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH 2NaClO3+4HCl = 2ClO2↑+2NaCl+2H2O+Cl2↑ 酸式滴定管 溶液蓝色恰好消失,且30s内不恢复原色 偏高 ![]()
【解析】
以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。根据流程图,粗盐水中加入氢氧化钠除去镁离子,再加入试剂X除去钙离子生成碳酸钙,因此X为碳酸钠,过滤后得到氢氧化镁和碳酸钙沉淀;用适量盐酸调节溶液的酸性,除去过量的氢氧化钠和碳酸钠得到纯净的氯化钠溶液,反应Ⅱ电解氯化钠溶液生成氢气和NaClO3,加入盐酸,发生反应Ⅲ2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,得到ClO2。据此分析解答。
(1)Ca2+应用Na2CO3除去,SO42-应用Ba2+除去,Mg2+应用NaOH除去,同时Na2CO3还要除去多余BaCl2,因此顺序是NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH;
答案为NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH;
(2)根据信息,反应III应是NaClO3与HCl反应生成ClO2,根据流程,其反应的方程式为2NaClO3+4HCl=2ClO2↑+2NaCl+2H2O+Cl2↑;
答案为2NaClO3+4HCl=2ClO2↑+2NaCl+2H2O+Cl2↑;
(3)①ClO2能用于自来水的消毒,即ClO2具有强氧化性,ClO2溶液应盛放在酸式滴定管中;
答案为酸式滴定管;
②锥形瓶溶液显蓝色,滴加Na2S2O3溶液过程中碘单质被消耗,达到终点的现象是:溶液恰好蓝色消失,且30s内不恢复原色;
答案为溶液恰好蓝色消失,且30s内不恢复原色;
③Na2S2O3被氧气氧化,则消耗Na2S2O3溶液的体积增大,测定结果偏高;
答案为偏高;
④根据反应方程式,建立关系式为2ClO2~5I2~10Na2S2O3,则ClO2的浓度为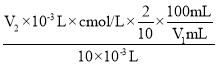 =
=![]() mol·L-1;
mol·L-1;
答案为![]() mol·L-1。
mol·L-1。

 阅读快车系列答案
阅读快车系列答案