题目内容
【题目】将2.7g铝和4.6g钠同时加入足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法中正确的是( )
A. 反应中放出的气体在标准状况下的体积为2.24 L
B. 参加反应的水的质量与加入铝的质量相等
C. 所得溶液中钠离子和铝离子物质的量之比为2∶1
D. 所得溶液中阳离子和阴离子的物质的量之比为1∶1
【答案】D
【解析】
4.6 g钠的物质的量为![]() 0.2mol,2.7gAl的物质的量为
0.2mol,2.7gAl的物质的量为![]() 0.1mol;Na和水反应:
0.1mol;Na和水反应:
2 Na + 2H2O ═2 NaOH+ H2↑
0.2mol 0.2mol 0.2mol0.1mol
生成n(NaOH)=0.2mol,
NaOH和Al反应:
2 Al+ 2 NaOH+ 2H2O ═ 2 NaAlO2+ 3 H2↑
0.1mol0.1mol0.1mol 0.1mol0.15mol
NaOH过量,Al完全反应,反应后的溶质物为0.1molNaAlO2、0.1molNaOH。
A、因钠与水反应和铝与碱反应都放出气体,气体在标准状况下的体积为22.4L/mol×(0.1+0.15)mol=5.6L,故A错误;
B、因反应共消耗水0.3mol,质量为5.4g,Al的质量为2.7g,则参加反应的水的质量与加入铝的质量不相等,故B错误;
C、因反应后溶液中含有0.1molNaAlO2、0.1molNaOH,没有Al3+,故C错误;
D、因反应后溶液中含有0.1molNaAlO2、0.1molNaOH,阳离子和阴离子都为1价离子,阳离子和阴离子的物质的量之比为1:1,故D正确。

 阅读快车系列答案
阅读快车系列答案【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。学习物质结构与性质,回答下列问题:
(1)太阳中的主要化学元素是氢和_______。
(2)氢负离子H-基态电子排布式为_______。
(3)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子H-的第一电离能为________。
(4)几种碱金属氢化物的部分性质如下表所示:
氢化物 | LiH | NaH | KH |
密度/g/cm3 | 0.78 | 1.43 | |
分解温度/℃ | 850 | 425 | 400 |
从化学结构的角度回答说明,分解温度LiH>NaH>KH___。
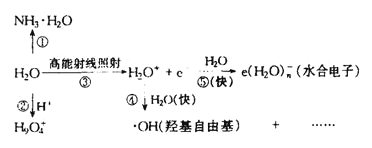
(5)水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中,中心原子的杂化类型是___,请画出H5O2+的结构式:______。当用高能射线照射液态水时,水分子便以一种新的方式电离,如图所示写出高能射线照射水的总反应的离子方程式_______。
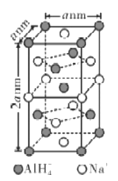
(6)氢化铝钠(NaAlH4)等复合氢化物是重要的有机还原剂。NaAlH4晶胞结构如图所示,NaAlH4晶体中,与Na+紧邻且等距的A1H4-有___个,设阿伏伽德罗常数为NA,则晶体的密度为___g·cm-3。
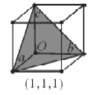
(7)在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如图则该立方晶胞体中(1,1,1)晶面共有___个。
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大