题目内容
从海藻灰中可以提取碘的主要反应为:2 I-+Cl2="2" Cl-+I2,下列说法正确的是
| A.该反应属于置换反应 | B.I-具有氧化性 |
| C.1mol氯气转移了1mol电子 | D.Cl2是还原剂 |
A
解析试题分析:置换反应是指一种单质与一种化合物反应生成另一种单质和另一种化合物,因此A选项是正确的。I-做还原剂,具有还原性,氯气做氧化剂,具有氧化性。
考点:考查置换反应以及氧化还原反应的相关知识点。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
下列是氧化还原反应也是吸热反应的是( )
| A.灼热的炭与二氧化碳反应 | B.铁和稀硫酸的反应 |
| C.氢氧化钡晶体的粉末和氯化铵晶体混合 | D.钢铁制品生锈的反应 |
铁溶于一定浓度的硝酸时,发生反应的离子方程式为:
aFe+bNO3-+cH+═dFe2++fFe3++gNO↑+hNO2↑+kH20,下列有关推断中,不正确的是( )
| A.2d+3f=3g+h |
| B.c+b=2d+3f |
| C.HNO3的氧化性强于Fe3+ |
| D.反应中每消耗5.6gFe,转移0.2mol~0.3mole- |
4.6g铜镁合金完全溶解于100mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到4480mLNO2和336 mLN2O4的混合气体(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是46:69 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1 |
| C.产生沉淀8.51 g |
| D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL |
已知常温下在溶液中可发生如下两个离子反应:Ge4++Fe2+===Fe3++Ge3+, Sn2++2Fe3+===2Fe2++Sn4+;由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ge3+ | B.Sn2+、Ge3+、Fe2+ |
| C.Ge3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ge3+ |
根据下列事实,可知X、Y、Z、W还原性由强到弱的顺序是
① X+Y2+=X2++Y ② Z+2H2O=Z(OH)2+H2↑ ③ Z2+比X2+的氧化性弱
④Y元素最高价氧化物对应水化物的碱性比W元素最高价氧化物对应水化物的碱性强
| A.X>Z>Y>W | B.Z>W>X>Y |
| C.Z>X>Y>W | D.Z>Y>X>W |
已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应为:2Fe3+ + Cu = 2Fe2+ + Cu2+),浓H2SO4还可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为
| A.H2SO4(浓) > Cu2+ > Fe3+ > Br2 | B.H2SO4(浓) > Br2 > Fe3+ > Cu2+ |
| C.Br2 > H2SO4(浓) > Cu2+ > Fe3+ | D.Cu2+ > Fe3+ > Br2 > H2SO4(浓) |
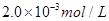 的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为____________________________________,则该加碘盐样品中碘元素的含量为______________________mg/Kg(用含w的代数式表示)。
的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为____________________________________,则该加碘盐样品中碘元素的含量为______________________mg/Kg(用含w的代数式表示)。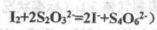 )
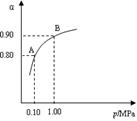
) 2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。