题目内容
20.合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-36 kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g)△H2=+216 kJ•mol-1
(1)氢气与氧气反应生成水蒸气的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1.
(2)现有1 mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气与足量CH4充分反应.
①若x=0.2,反应①放出的能量为-14.4kJ.
②若x=0.5,反应①与②吸收的总能量为+66.9kJ.
③若x=0.65时,反应①与②放出(或吸收)的总能量为0.
分析 (1)据热化学方程式和盖斯定律计算写出热化学方程式;
(2)据图象写出水与甲烷反应的热化学方程式和氧气与甲烷反应的热化学方程式,再据热化学方程式计算.
解答 解:(1)①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-36 kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g)△H2=+216 kJ•mol-1
依据盖斯定律①-②得到氢气与氧气反应生成水蒸气的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1;
(2)据图象分析,CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216KJ/mol,CH4(g)+$\frac{1}{2}$O2(g)=CO(g)+2H2(g)△H=-36KJ/mol,
①若x=0.2,有0.8molH2O(g)和0.2molO2(g),0.2mol氧气反应放热0.2mol×36KJ/mol×2=14.4KJ,故答案为:-14.4;
②若x=0.5,当H2O(g)与O2(g)的物质的量之比为1,有0.5molH2O(g)和0.5molO2(g),0.5mol水蒸气反应吸热0.5mol×205.8KJ/mol=102.9KJ,0.mol氧气反应放热0.5mol×36KJ/mol×2=36KJ,总吸收能量为102.9KJ-36KJ=66.9KJ,故答案为:+66.9;
③反应①与②放出(或吸收)的总能量为0时,设水蒸气物质的量为amol,则氧气物质的量为(1-a)mol,有216KJ/mol×amol=36KJ/mol×2×(1-a)mol,解得:a=0.26mol,所以x=$\frac{1-0.35}{1}$=0.65,故答案为:0.65.
点评 本题考查了据能量变化图书写热化学方程式和据热化学方程式的计算,题目难度中等.

 天天练口算系列答案
天天练口算系列答案| A. | 10g 46%的乙醇溶液所含氢原子数为1.2NA | |
| B. | 0.5 mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4g,其中所含硫原子数为1.4NA |
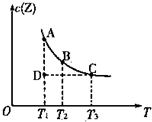 在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )
在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )| A. | A点与B点相比,B点的c(X)大 | B. | A点与C点的化学反应速率:A<C | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | 该反应的正反应是吸热反应 |
| 选项 | A | B | C | D |
| n(CO2)(mo1) | 1 | 2 | 3 | 4 |
| n(沉淀)(mo1) | 1 | 1 | 2 | 2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2mol•L-1 | B. | 1.6mol•L-1 | C. | 0.8mol•L-1 | D. | 0.4mol•L-1 |
| A. | 16.8L | B. | 14L | C. | 19.6L | D. | 18.4L |
| A. | 该烃的名称是2-乙基-1-丁烯 | |
| B. | 该烃与H2加成得到的烷烃的名称是3-甲基戊烷 | |
| C. | 该烃可使溴水褪色,但不能与溴发生取代反应 | |
| D. | 该烃与HCl加成得两种卤代烃 |