题目内容
11.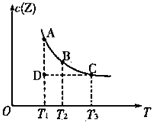 在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )
在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )| A. | A点与B点相比,B点的c(X)大 | B. | A点与C点的化学反应速率:A<C | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | 该反应的正反应是吸热反应 |
分析 A、由图可知,温度越高平衡时c(Z)越小,说明升高温度平衡向逆反应移动,A点与B点相比,A点的c(X)大;
B、由图可知,A点在曲线上属于平衡状态据此分析速率;
C、在反应进行到D点时,没有到达平衡状态,所以V正>V逆;
D、温度越高平衡时c(Z)越小,说明升高温度平衡向逆反应移动.
解答 解:A、由图可知,温度越高平衡时c(Z)越小,说明升高温度平衡向逆反应移动,A点与B点相比,B点的c(X)大,故A正确;
B、由图可知,A、C点在曲线上属于平衡状态,T3>T1,温度越高反应速率越大,A点与C点的化学反应速率:A<C,故B正确;
C、在反应进行到D点时,没有到达平衡状态,要达到平衡c(Z)的浓度要增大,即向正反应方向移动,所以V正>V逆,故C正确;
D、温度越高平衡时c(Z)越小,说明升高温度平衡向逆反应移动,所以正反应为放热反应,故D错误;
故选D.
点评 本题以化学平衡图象为载体,考查温度对平衡移动的影响,难度中等,注意曲线的各点都处于平衡状态.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
1.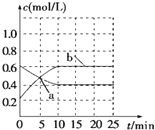 2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
 2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )| A. | a点表示反应处于平衡状态 | |
| B. | 25 min末,若增大压强,化学平衡常数增大 | |
| C. | 25 min末,若升高温度,NO2的体积分数减小 | |
| D. | 10min内用N2O4表示的平均速率为0.02mol•L-1•min-1 |
19.下列叙述中错误的是( )
| A. | 质量相等,密度不等的N2和C2H4两种气体含有的分子数一定相等 | |
| B. | 同温同压下,等体积的H2和He气含有的质子数相等 | |
| C. | 某物质经分析仅含一种元素,此物质可能是纯净物也可能是混合物 | |
| D. | FeCl3溶液呈电中性,Fe(OH)3胶体带有电荷 |
3.有BaCl2和KCl的混合溶液VL,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗m mol H2SO4、n mol AgNO3.据此得知原混合溶液中的K+的物质的量浓度为( )
| A. | $\frac{(n-2m)}{V}mol•{L^{-1}}$ | B. | $\frac{(n-m)}{V}mol•{L^{-1}}$ | C. | $\frac{(2n-2m)}{V}mol•{L^{-1}}$ | D. | $\frac{(2n-4m)}{V}mol•{L^{-1}}$ |
 CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知: