题目内容
【题目】下列实验操作、实验现象以及得出的结论均正确的是( )
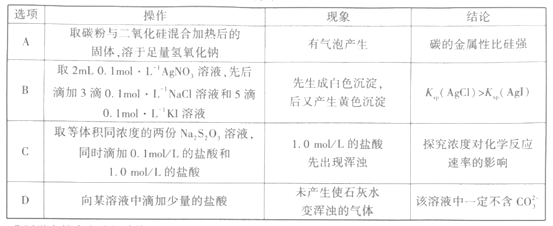
A.AB.BC.CD.D
【答案】C
【解析】
A.C和SiO2在高温下能够发生反应,2C+SiO2![]() Si+2CO↑,生成的Si能够与NaOH反应放出氢气,但是该反应能够发生是由于生成的CO离开反应体系,促使平衡正向移动,并不是C的金属性强于Si,A错误;
Si+2CO↑,生成的Si能够与NaOH反应放出氢气,但是该反应能够发生是由于生成的CO离开反应体系,促使平衡正向移动,并不是C的金属性强于Si,A错误;
B.2mL 0.1mol·L-1AgNO3溶液中,加入3滴0.1mol·L-1NaCl溶液,生成白色的AgCl,溶液中AgNO3过量,再加入KI溶液,I-会和Ag+反应生成AgI,并不是白色沉淀AgCl化为黄色沉淀AgI,因此不能比较两者Ksp的大小,B错误;
C.同浓度的两份Na2S2O3溶液加入相同体积不同浓度的盐酸,浓度大的盐酸先出现沉淀,说明其他条件一定时,浓度越大,化学反应速率越大,C正确;
D.向溶液中加入少量盐酸,CO32-和H+生成HCO3-,并不会生成CO2,因此不能确定溶液中不含CO32-,D错误。
答案选D。

 小学期末标准试卷系列答案
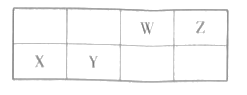
小学期末标准试卷系列答案【题目】有七种元素,其中A、X、Y、D、E为短周期主族元素,Z、G为第四周期元素,它们的原子序数依次增大。请回答问题。
A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
X | 元素原子的核外 |
Y | 原子的第一至第四电离能分别是: |
D | 原子核外所有 |
E | 元素的主族序数与周期数的差为4 |
Z | 是前四周期中电负性最小的元素 |
G | 在周期表的第七列 |
(1)已知![]() 为离子化合物,写出其电子式_______________。
为离子化合物,写出其电子式_______________。
(2)X基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈_____形;![]() 的空间构型为__________。
的空间构型为__________。
(3)某同学根据上述信息,推断Y基态原子的核外电子排布为:
![]()
该同学所画的电子排布图违背了________________________。
(4)G位于元素周期表的_________区,原子结构示意图为____________________。
(5)![]() 中心原子的杂化方式为_________,其空间构型为____________________。
中心原子的杂化方式为_________,其空间构型为____________________。
(6)Z元素的基态原子价电子排布式为_______________________。