题目内容
【题目】有七种元素,其中A、X、Y、D、E为短周期主族元素,Z、G为第四周期元素,它们的原子序数依次增大。请回答问题。
A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
X | 元素原子的核外 |
Y | 原子的第一至第四电离能分别是: |
D | 原子核外所有 |
E | 元素的主族序数与周期数的差为4 |
Z | 是前四周期中电负性最小的元素 |
G | 在周期表的第七列 |
(1)已知![]() 为离子化合物,写出其电子式_______________。
为离子化合物,写出其电子式_______________。
(2)X基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈_____形;![]() 的空间构型为__________。
的空间构型为__________。
(3)某同学根据上述信息,推断Y基态原子的核外电子排布为:
![]()
该同学所画的电子排布图违背了________________________。
(4)G位于元素周期表的_________区,原子结构示意图为____________________。
(5)![]() 中心原子的杂化方式为_________,其空间构型为____________________。
中心原子的杂化方式为_________,其空间构型为____________________。
(6)Z元素的基态原子价电子排布式为_______________________。
【答案】![]() 3 哑铃 直线形 泡利不相容原理 d
3 哑铃 直线形 泡利不相容原理 d 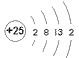 sp3 三角锥形 4s1
sp3 三角锥形 4s1
【解析】
由题给信息可知,A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;X元素原子的核外p电子数比s电子数少1,则X有2个电子层,电子排布式为1s22s22p3,故B为N元素;由Y原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故Y为Mg元素;D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,则D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,则E为Cl元素;Z是前四周期中电负性最小的元素,Z为第四周期元素,则Z为K元素,G在第四周期周期表的第7列,则G为Mn元素。
(1)XA5为NH5,NH5是由NH4+与H—形成的离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)X为N元素,N基态原子中能量最高的电子在2p轨道上,p电子云在空间有3个伸展方向,原子轨道呈哑铃形;N3—与CO2的原子个数都为3、价电子数都为22,互为等电子体,等电子体具有相同的空间构型,CO2的空间构型为直线形,则N3—的空间构型也为直线形,故答案为:3;哑铃;直线形;
(3) Y为Mg元素,由图片可知,Mg的核外电子排布中3s轨道2个电子自旋方向相同,违背了泡利不相容原理,故答案为:泡利不相容原理;
(4) G为Mn元素,原子序数为25,位于周期表第四周期ⅦB族,在周期表的d区,原子结构示意图为 ,故答案为:d;
,故答案为:d; ;
;
(5) DE3为PCl3,PCl3分子中中心原子P的价层电子对数为4,故P原子为sp3杂化,孤对电子数为1,则空间构型为三角锥形,故答案为:sp3;三角锥形;
(6)Z为K元素,原子序数为19,最外层电子数为1,则基态原子价电子排布式为4s1,故答案为:4s1。

【题目】对比类推法是一种常用的学习和研究方法。下列离子方程式的书写正确且类推合理的是
选项 | 离子方程式 | 类推 |
A | 家庭漂白原理:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
B | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | 向FeI2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
C | 用石墨电极电解NaCl饱和溶液:2H2O+2Cl- | 用石墨电极电解AlCl3饱和溶液:2H2O+2Cl- |
D | 明矾净水:Al3++3H2O | 硫酸铁净水:Fe3++3H2O |
A.AB.BC.CD.D