题目内容
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
(1)高铁酸钠主要通过如下反应制取:
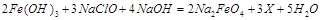 ,则X的化学式为 。
,则X的化学式为 。
(2)高铁酸钠是一种新型净水剂,在水中可以发生如下反应:
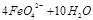

 。由此看来,高铁酸钠能够杀菌消毒是因为它具有 性,而能够除去水中悬浮物是因为 。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有 性,而能够除去水中悬浮物是因为 。
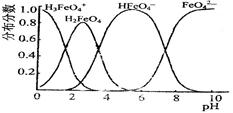
(3)FeO42-在水溶液中的存在形态如图所示。向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为 。
(4)高铁电池是一种新型可充电电池,电解池为碱溶液,其反应式为

 则电池正极材料是 ,充电时电池正极 (填“得”“失”)电子,放电时电池的负极反应式为 。
则电池正极材料是 ,充电时电池正极 (填“得”“失”)电子,放电时电池的负极反应式为 。
(1)高铁酸钠主要通过如下反应制取:
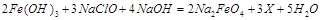 ,则X的化学式为 。
,则X的化学式为 。(2)高铁酸钠是一种新型净水剂,在水中可以发生如下反应:
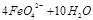

 。由此看来,高铁酸钠能够杀菌消毒是因为它具有 性,而能够除去水中悬浮物是因为 。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有 性,而能够除去水中悬浮物是因为 。(3)FeO42-在水溶液中的存在形态如图所示。向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为 。

(4)高铁电池是一种新型可充电电池,电解池为碱溶液,其反应式为

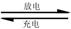
 则电池正极材料是 ,充电时电池正极 (填“得”“失”)电子,放电时电池的负极反应式为 。
则电池正极材料是 ,充电时电池正极 (填“得”“失”)电子,放电时电池的负极反应式为 。C
(1)由质量守恒定律可得X为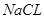 ;
;
(2)高铁酸钠能够杀菌消毒是因为它具有强氧化性,能杀菌、消毒;而能够除去水中悬浮物是因为反应生成氢氧化铁胶体,能够吸附水中的悬浮杂质;
(3)离子方程式为: ;
;
(4)由总方程式可知,电池正极材料为: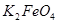 ;充电时电池正极得一电子,放电时电池的负极反应式为:
;充电时电池正极得一电子,放电时电池的负极反应式为: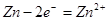 ;
;
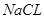 ;
;(2)高铁酸钠能够杀菌消毒是因为它具有强氧化性,能杀菌、消毒;而能够除去水中悬浮物是因为反应生成氢氧化铁胶体,能够吸附水中的悬浮杂质;
(3)离子方程式为:
 ;
;(4)由总方程式可知,电池正极材料为:
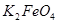 ;充电时电池正极得一电子,放电时电池的负极反应式为:
;充电时电池正极得一电子,放电时电池的负极反应式为: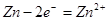 ;
;
练习册系列答案
相关题目
 ==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
==6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,
 况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为
况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为