题目内容
常温下,将1.92g铜加入到100mlH2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气。下列有关结论不正确的是( )
| A.溶解的铁粉为2.8g | B.原溶液中C(SO42-)=0.5mol/L |
| C.原混合溶液中C(H+)=1.2mol/L | D.原溶液中n(NO3-)=0.08mol |
D
铜的物质的量为0.03mol,氢气的物质的量为0.02mol;发生的反应依次分别为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
0.03 0.08 0.02 0.03
Fe + Cu2+=Cu+Fe2+
0.03 0.03
Fe + 2H+= Fe2++H2
0.02 0.04 0.02
可知,原溶液中NO3-的物质的量为0.02mol,H+的物质的量为0.12mol,即可求出SO42—的物质的量为0.05mol
共溶解的铁粉的物质的量为0.05mol,质量为2.8g
故答案为D
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
0.03 0.08 0.02 0.03
Fe + Cu2+=Cu+Fe2+
0.03 0.03
Fe + 2H+= Fe2++H2
0.02 0.04 0.02
可知,原溶液中NO3-的物质的量为0.02mol,H+的物质的量为0.12mol,即可求出SO42—的物质的量为0.05mol
共溶解的铁粉的物质的量为0.05mol,质量为2.8g
故答案为D

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
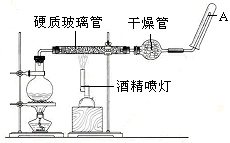

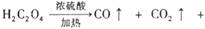
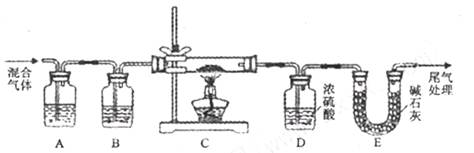
 。下列装置中,可用作上述反应制取气体的是(填编号)。
。下列装置中,可用作上述反应制取气体的是(填编号)。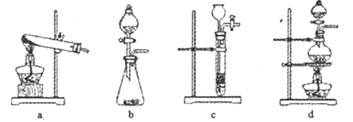
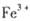 外还可能含有
外还可能含有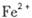 。若要确认其中的
。若要确认其中的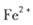 .应选用 ________________(填编号)。
.应选用 ________________(填编号)。
 量浓度以及产生氢气的体积。(注:氢气的体积测定环境为标准状况)
量浓度以及产生氢气的体积。(注:氢气的体积测定环境为标准状况)