题目内容
8. (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2.0;若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为$\frac{2}{3}$mol•L-1;
②下列措施中能使平衡时K增大的是A(填选项字母).
A.升高温度 B.增大压强C.再充入一定量的CO2 D.再加入一定量铁粉.
分析 (1)据已知热化学方程式,利用盖斯定律解答;据化学平衡常数表达式分析;
(2)①依据平衡常数概念写出,用生成物平衡浓度幂次方乘积除以反应物平衡浓度的幂次方乘积得到平衡常数表达式,代入图上数据即可求K;据K求算二氧化碳的平衡浓度;
②$\frac{c(CO)}{c(C{O}_{2})}$是该反应的平衡常数表达式,平衡常数随温度变化,结合平衡移动原理分析判断
解答 解:(1)已知①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,②Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,据盖斯定律,①-②得:CO2(g)+H2(g)?CO(g)+H2O(g)△H=△H1-△H2;反应的K=$\frac{[CO][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]}$,K1=$\frac{c(CO)}{c(C{O}_{2})}$,K2=$\frac{[{H}_{2}]}{[{H}_{2}O]}$,所以K=$\frac{{K}_{1}}{{K}_{2}}$;K1随温度的升高而增大,K2随温度升高而减小,则K随温度升高而增大,说明正反应吸热,故答案为:△H1-△H2;$\frac{{K}_{1}}{{K}_{2}}$;吸热;
(2)①据图分析平衡时二氧化碳和CO的浓度分别为0.5mol/L和1mol/L,K=$\frac{c(CO)}{c(C{O}_{2})}$=$\frac{1.0mol/L}{0.5mol/L}$=2.0;若CO2的起始浓度为2.0mol•L-1,据方程式可知,反应的二氧化碳的浓度与生成CO浓度相等,设为xmol/L,则平衡时二氧化碳浓度为(2.0-x)mol/L,K=$\frac{c(CO)}{c(C{O}_{2})}$=$\frac{x}{2.0-x}$=2.0,x=$\frac{4}{3}$,平衡时二氧化碳浓度=2.0-$\frac{4}{3}$=$\frac{2}{3}$mol/L,
故答案为:2.0;$\frac{2}{3}$;
②平衡常数随温度变化,不随浓度压强等因素变化,反应是吸热反应,升温平衡时K增大;
A.升高温度,平衡正向进行,平衡常数增大,故A正确;
B.增大压强,平衡不动,平衡常数不变,故B错误;
C.充入一定量CO2,平衡正向进行,但平衡常数不变,故C错误;
D.再加入一定量铁粉,平衡常数不变,故D错误;
故答案为:A.
点评 本题考查化学平衡影响因素、平衡状态的判断、化学平衡的计算,题目计算量较大,难度较大.

 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,如图所示,四种物质间反应的离子方程式书写不正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,如图所示,四种物质间反应的离子方程式书写不正确的是( )| A. | OH-+H+═H2O | B. | 2OH-+Cu2+═Cu(OH)2↓ | ||
| C. | Fe+Cu2+═Cu+Fe2+ | D. | Fe+2H+═Fe3++H2↑ |
| A. | 标准状况下,2.24 L己烷含有分子的数目为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | Na2O2与足量H2O反应产生0.1molO2,转移电子的数目为0.2NA | |
| D. | 1mol甲醇中含有C-H键的数目为4NA |
 CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。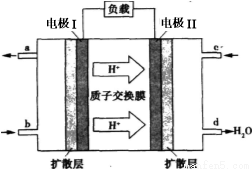
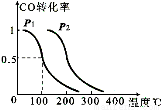
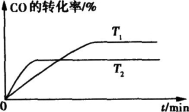
 =-483.6kJ/mol
=-483.6kJ/mol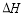 =+67.7kJ/mol
=+67.7kJ/mol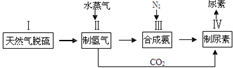
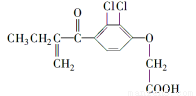
 ,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.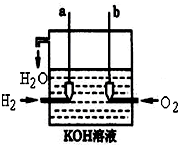 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.