题目内容
(10分)以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题:
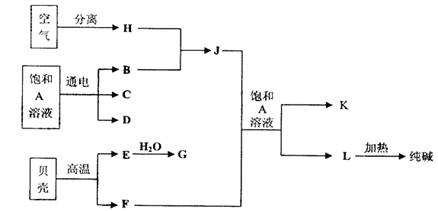
(1)电解A溶液反应的离子方程式为 ;
(2)写出C与D制取消毒剂的化学方程式 ;
(3)若要使工业合成J反应的平衡向生成J的方向移动,可采取的措施有
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离J
(4)将F和J通入A的饱和溶液中的顺序为
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。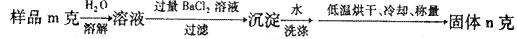
则计算样品中NaCl的质量分数的数学表达式为:

(1)电解A溶液反应的离子方程式为 ;
(2)写出C与D制取消毒剂的化学方程式 ;
(3)若要使工业合成J反应的平衡向生成J的方向移动,可采取的措施有
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离J
(4)将F和J通入A的饱和溶液中的顺序为
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
|
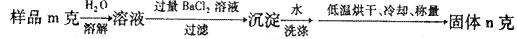
则计算样品中NaCl的质量分数的数学表达式为:
(1)2H2O+2Cl- Cl2↑+H2↑+2OH- (2)Cl2 + NaOH="=NaClO" +NaCl +H2O
Cl2↑+H2↑+2OH- (2)Cl2 + NaOH="=NaClO" +NaCl +H2O
(3)B D (4)B (5)(1- )
) 100%
100%
 Cl2↑+H2↑+2OH- (2)Cl2 + NaOH="=NaClO" +NaCl +H2O
Cl2↑+H2↑+2OH- (2)Cl2 + NaOH="=NaClO" +NaCl +H2O (3)B D (4)B (5)(1-
 )
) 100%
100%(1)海水中含有氯化钠,所以A是氯化钠,电解的方程式为
2H2O+2Cl- Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)氯气溶于氢氧化钠溶液中甲生成消毒剂,方程式为Cl2 + NaOH="=NaClO" +NaCl +H2O。
(3)J是氨气,合成氨是体积减小的放热的可逆反应,所以BD可以是平衡向正反应方向移动。升高温度,平衡向逆反应方向移动。催化剂不能改变平衡状态,答案选BD。
(4)由于CO2在水中的溶解度不大,所以应该先通入氨气,然后再通入CO2,答案选B。
(5)n固体是碳酸钡,所以根据原子守恒可知,样品中碳酸钠的质量是 。样品中NaCl的质量分数的数学表达式为(1-
。样品中NaCl的质量分数的数学表达式为(1- )
) 100%
100%
2H2O+2Cl-
 Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。(2)氯气溶于氢氧化钠溶液中甲生成消毒剂,方程式为Cl2 + NaOH="=NaClO" +NaCl +H2O。
(3)J是氨气,合成氨是体积减小的放热的可逆反应,所以BD可以是平衡向正反应方向移动。升高温度,平衡向逆反应方向移动。催化剂不能改变平衡状态,答案选BD。
(4)由于CO2在水中的溶解度不大,所以应该先通入氨气,然后再通入CO2,答案选B。
(5)n固体是碳酸钡,所以根据原子守恒可知,样品中碳酸钠的质量是
 。样品中NaCl的质量分数的数学表达式为(1-
。样品中NaCl的质量分数的数学表达式为(1- )
) 100%
100%
练习册系列答案
相关题目
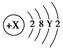 。则X、Y及该原子3p能级上的电子数分别为 ( )
。则X、Y及该原子3p能级上的电子数分别为 ( )