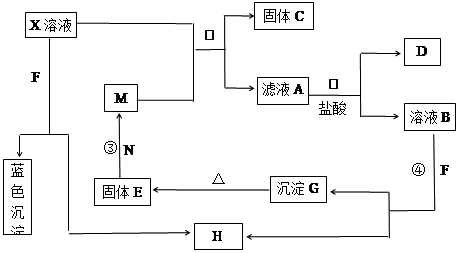
题目内容
下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题。
(1)元素④的名称是______,元素④在周期表中所处位置____________,从元素原子得失电子的角度看,元素④具有____________(填“氧化性”或“还原性”)。
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:___________________________________(写氢化物的化学式)。
(3)元素⑦的原子结构示意图是____________。
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式______________________;这一反应是____________(填“吸热”或“放热”)反应。
(5)用电子式表示①与⑨反应得到的化合物的形成过程___________________________。
请按要求回答下列问题。
(1)元素④的名称是______,元素④在周期表中所处位置____________,从元素原子得失电子的角度看,元素④具有____________(填“氧化性”或“还原性”)。
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:___________________________________(写氢化物的化学式)。
(3)元素⑦的原子结构示意图是____________。
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式______________________;这一反应是____________(填“吸热”或“放热”)反应。
(5)用电子式表示①与⑨反应得到的化合物的形成过程___________________________。
(1)氧或氧元素 第二周期ⅥA族 氧化性 (2)PH3<H2S<H2O
(3)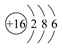
(4)2Na+O2 Na2O2 放热
Na2O2 放热
(5)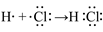
(3)
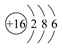
(4)2Na+O2
 Na2O2 放热
Na2O2 放热(5)
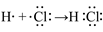
试题分析:元素④是处在第二周期,第ⅥA族,是氧元素。在元素周期表中,同一周期中,从左到右,元素的非金属性越来越强,氧化性越来越强,元素对应的氢化物稳定性也越来越好,而同一主族中,从上到下,元素的非金属性越来越弱,元素对应的氢化物稳定性也越来越差,故稳定性:PH3<H2S<H2O。
(3)元素⑦是硫元素,其原子结构示意图为
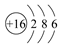 。
。(4)元素⑤处在第三周期第ⅠA,判断为Na,在氧气中燃烧的化学方程式为2Na+O2
 Na2O2 该反应为放出大量的热量,为放热反应。
Na2O2 该反应为放出大量的热量,为放热反应。(5)首先根据①与⑨在元素周期中的位置快速判断两者分别为H和Cl,两者形成HCl,其电子式形成方程为:
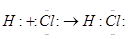
点评:本题综合性较强,涵盖了必修2第一章的全部知知识,但难度不大,侧重对学生基础知识的巩固。

练习册系列答案
相关题目

 转变为
转变为 时,这一过程中释放能量
时,这一过程中释放能量