题目内容
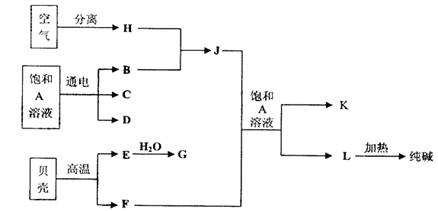
工业上用铝土矿(主要成分为Al2O3·xH2O,Fe2O3、SiO2等)提取纯Al2O3做冶炼铝的原料,提取时操作过程如下图,指出图中操作错误的是


| A.④⑤ | B.③④ | C.②⑤ | D.①② |
A
铝土矿灼烧得到的不挥发性物质是氧化铝、氧化铁和二氧化硅。加入过量的盐酸,二氧化硅不溶解,氧化铝和氧化铁溶解,所以滤液是氯化铁、氯化铝和剩余的盐酸。然后加入过量的氢氧化钠,得到氢氧化铁沉淀和偏铝酸钠,即此时的滤液中含有偏铝酸钠、氯化钠和剩余的氢氧化钠。如果加入过量的盐酸,由于氢氧化铝是两性氢氧化物,能溶于盐酸,所以得不到氢氧化铝沉淀,因此④不正确。应该通入足量CO2气体,才能生成氢氧化铝沉淀,氢氧化铝灼烧才能得到氧化铝,所以⑤也不正确。答案选A。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
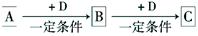
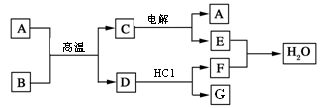
 NaCl +D
NaCl +D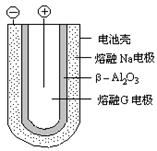
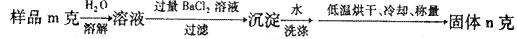
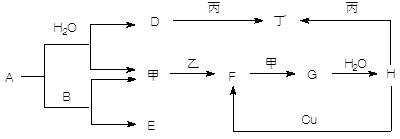
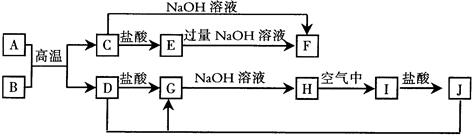



 。
。 。
。