题目内容
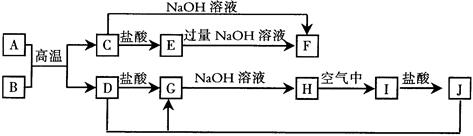
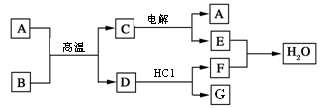
(12分)物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。(提示:葡萄糖结构简式为CH2OH(CHOH)4CHO )
请回答下列问题:

(1)写出下列物质的化学式:B 、E 、G
(2)利用电解精炼法可提纯C物质,在该电解反应中阳极电极材料是 ,阴极电极材料是 ,电解质溶液是
(3)反应②的化学方程式是 。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K = (保留一位小数)若温度不变,再加入0.50 mol氧气后重新达到平衡,则:
B的平衡浓度 (填“增大”、“不变”或“减小”),
氧气的转化率 (填“升高”、“不变”或“降低”),
D的体积分数 (填“增大”、“不变”或“减小”)。
请回答下列问题:

(1)写出下列物质的化学式:B 、E 、G
(2)利用电解精炼法可提纯C物质,在该电解反应中阳极电极材料是 ,阴极电极材料是 ,电解质溶液是
(3)反应②的化学方程式是 。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K = (保留一位小数)若温度不变,再加入0.50 mol氧气后重新达到平衡,则:
B的平衡浓度 (填“增大”、“不变”或“减小”),
氧气的转化率 (填“升高”、“不变”或“降低”),
D的体积分数 (填“增大”、“不变”或“减小”)。
(1) SO2 H2SO4 Cu2O
(2)粗铜 精铜 CuSO4溶液
(3)Cu+2H2SO4(浓)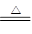 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)23.8 减小 降低 减小
(2)粗铜 精铜 CuSO4溶液
(3)Cu+2H2SO4(浓)
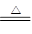 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O(4)23.8 减小 降低 减小
本题是无机框图题,根据是杂质突破点。G为砖红色沉淀,即G是氧化亚铜,则F是氢氧化铜,所以C是铜,E是硫酸。因此D是三氧化硫,B是SO2,这说明A含有铜和硫元素。
(2)粗铜精炼是,阳极是粗铜,阴极是纯铜,电解质是硫酸铜。
(3)在加热的条件下,浓硫酸和铜反应生成硫酸铜、SO2和水,方程式为
Cu+2H2SO4(浓)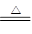 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(4)反应①的方程式为2SO2+O2 2SO3,平衡时生成三氧化硫是0.12mol,则消耗SO2和氧气分别0.12mol和0.06mol,剩余SO2和氧气分别是0.11mol和0.05mol,所以平衡常数为
2SO3,平衡时生成三氧化硫是0.12mol,则消耗SO2和氧气分别0.12mol和0.06mol,剩余SO2和氧气分别是0.11mol和0.05mol,所以平衡常数为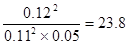 。增大氧气浓度,平衡向正反应方向移动,SO2的浓度减小,氧气的转化率减小。原平衡中三氧化硫的体积分数为
。增大氧气浓度,平衡向正反应方向移动,SO2的浓度减小,氧气的转化率减小。原平衡中三氧化硫的体积分数为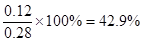 。如果再加入0.5mol氧气,则三氧化硫最多生成0.23mol。其体积分数为
。如果再加入0.5mol氧气,则三氧化硫最多生成0.23mol。其体积分数为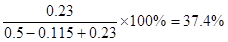 ,所以三氧化硫的体积分数减小。
,所以三氧化硫的体积分数减小。
(2)粗铜精炼是,阳极是粗铜,阴极是纯铜,电解质是硫酸铜。
(3)在加热的条件下,浓硫酸和铜反应生成硫酸铜、SO2和水,方程式为
Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。(4)反应①的方程式为2SO2+O2
 2SO3,平衡时生成三氧化硫是0.12mol,则消耗SO2和氧气分别0.12mol和0.06mol,剩余SO2和氧气分别是0.11mol和0.05mol,所以平衡常数为
2SO3,平衡时生成三氧化硫是0.12mol,则消耗SO2和氧气分别0.12mol和0.06mol,剩余SO2和氧气分别是0.11mol和0.05mol,所以平衡常数为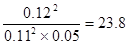 。增大氧气浓度,平衡向正反应方向移动,SO2的浓度减小,氧气的转化率减小。原平衡中三氧化硫的体积分数为
。增大氧气浓度,平衡向正反应方向移动,SO2的浓度减小,氧气的转化率减小。原平衡中三氧化硫的体积分数为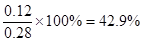 。如果再加入0.5mol氧气,则三氧化硫最多生成0.23mol。其体积分数为
。如果再加入0.5mol氧气,则三氧化硫最多生成0.23mol。其体积分数为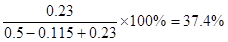 ,所以三氧化硫的体积分数减小。
,所以三氧化硫的体积分数减小。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 NaCl +D
NaCl +D