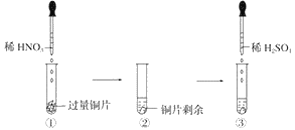
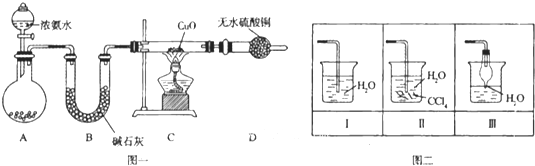
题目内容
【题目】制备钙掺杂纳米Fe3O4,并模拟吸附废水中磷元素的主要实验流程如下:

已知:①CaO2能氧化溶液中的FeCl2,反应生成Fe(OH)3和Fe3+。
②掺杂的Ca2+嵌入Fe3O4中,洗涤时不损失,吸附时不形成Ca3(PO4)2等沉淀。
③溶液的pH对吸附剂表面所带电荷有影响。pH越高,表面所带负电荷越多; pH越低,表面所带正电荷越多。
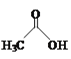
(1)向FeCl2、FeCl3混合溶液中滴加NaOH溶液,一定条件下反应生成Fe3O4,其离子方程式为___________。
(2)步骤Ⅱ调节pH至11,共沉淀需在70℃条件下进行,适宜的加热方式为________。为提高共沉淀效果,还可采取的措施为_______________。
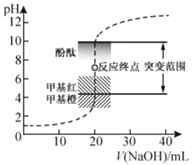
(3)磷元素的吸附效果、H3PO4水溶液中含磷物种分布分数与pH的关系分别如图1和图2所示。

①步骤Ⅳ用KH2PO4溶液模拟废水,测得酸性条件下(pH > 2)对磷元素吸附量较大,原因是:pH越低,吸附剂表面所带正电荷越多,有利于吸附阴离子;___________________
②步骤Ⅴ将吸附剂取出,用碱液解吸回收磷。结合表中数据,分析钙掺杂纳米Fe3O4吸附剂与其他类型吸附剂相比的优势有:________。
不同类型吸附剂对磷酸盐吸附能力比较
吸附剂 | 本产品 | 纯Fe3O4 | 陶瓷材质 |
吸附量/mg·g-1 | 24.1 | 5.0 | 12.5 |
(4)请设计从步骤Ⅱ反应结束后的烧瓶中获取钙掺杂纳米Fe3O4产品的实验方案:用磁铁将沉淀物和溶液分离,______________,用筛网筛分得到产品 (实验中须使用的试剂和仪器有:蒸馏水、无水乙醇、pH计、研钵、烘箱)。
【答案】Fe2++2Fe3++8OH-= Fe3O4 ↓+ 4H2O 水浴加热 搅拌 磷元素酸性条件下主要以H2PO4-形态存在,比HPO42-所带负电荷少,有利于被吸附 吸附量大(或解吸后可以循环利用) 用蒸馏水洗涤沉淀物至洗出液用pH计检测接近中性,再用无水乙醇洗涤,将所得固体置于烘箱中烘干后,在研钵中研磨
【解析】
根据流程:FeCl24H2O用CaO2氧化,部分被氧化为Fe(OH)3和Fe3+,加入水得到FeCl2、FeCl3混合溶液,加入NaOH溶液制得钙掺杂纳米Fe3O4,钙掺杂纳米Fe3O4吸附KH2PO4溶液,加入NaOH溶液解吸回收磷,
(1)根据电荷守恒、质量守恒书写可得;
(2)100℃以下与水浴加热;搅拌可以促进混合;
(3)①根据图,磷元素酸性条件下主要以H2PO4-形态存在,结合已知③分析;
②由表可知,钙掺杂纳米Fe3O4吸附剂吸附能力强;
(4)从步骤Ⅱ反应结束后的烧瓶中获取钙掺杂纳米Fe3O4产品,用磁铁将沉淀物和溶液分离,用蒸馏水洗涤至洗涤液显中性,再用无水乙醇洗涤,最后烘干研磨。
(1)FeCl2、FeCl3混合溶液中滴加NaOH溶液,一定条件下反应生成Fe3O4,离子反应为:Fe2++2Fe3++8OH=Fe3O4↓+4H2O;
故答案为:Fe2++2Fe3++8OH=Fe3O4↓+4H2O;
(2)共沉淀需在70℃条件下进行,选用水浴加热;搅拌可以促进反应物混合,提高共沉淀效果;
故答案为:水浴加热;搅拌;
(3)①已知:pH越低,吸附剂表面所带正电荷越多,有利于吸附阴离子,由图可知,磷元素酸性条件下主要以H2PO4形态存在,比HPO42所带负电荷少,有利于被吸附;
故答案为:磷元素酸性条件下主要以H2PO4形态存在,比HPO42所带负电荷少,有利于被吸附;
②由表可知,钙掺杂纳米Fe3O4吸附剂吸附能力强,故其吸附量大,同时解吸后可以循环利用;
故答案为:吸附量大(或解吸后可以循环利用);
(4)从步骤Ⅱ反应结束后的烧瓶中获取钙掺杂纳米Fe3O4产品:用磁铁将沉淀物和溶液分离,用蒸馏水洗涤沉淀物至洗出液用pH计检测接近中性,再用无水乙醇洗涤,将所得固体置于烘箱中烘干后,在研钵中研磨,用筛网筛分得到产品;
故答案为:用蒸馏水洗涤沉淀物至洗出液用pH计检测接近中性,再用无水乙醇洗涤,将所得固体置于烘箱中烘干后,在研钵中研磨。

【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是_____。
②求3~4 min时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液
C. KNO3溶液D.Na2SO4溶液
(3)某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
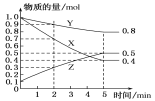
①该反应的化学方程式是_________。
②该反应达到平衡状态的标志是____(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z