题目内容
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是_____。
②求3~4 min时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液
C. KNO3溶液D.Na2SO4溶液
(3)某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
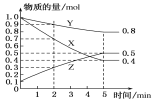
①该反应的化学方程式是_________。
②该反应达到平衡状态的标志是____(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z
【答案】2~3 因该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快 0.025 mol·L-1·min-1 C 3X(g)+Y(g)2Z(g) AC
【解析】
根据题中表格数据,可判断那一段速率最快,由反应放热解释;根据H+浓度减小,反应速率减慢,进行判断;根据题中图示,由变化量与计量系数关系,判断反应物和生成物和写出化学方程式;根据化学平衡的本质特征及相关量的变与不变,判断平衡状态;据此解答。
(1)①在相同条件下,反应速率越大,相同时间内收集的气体越多;由表中数据可知,反应速率最大的时间段是2~3 min,原因是:该反应是放热反应,温度越高,反应速率越大,且盐酸浓度较大,所以反应速率较快;答案为2~3 ,该反应是放热反应,此时温度高,盐酸浓度较大,反应速率较快。
②3~4分钟时间段,收集的氢气体积V(H2)=(576-464)mL=112mL,n(H2)=![]() =0.005mol,根据Zn+2HCl=ZnCl2+H2↑可知,消耗的n(HCl)=2n(H2)=2×0.005mol=0.01mol,则v(HCl)=
=0.005mol,根据Zn+2HCl=ZnCl2+H2↑可知,消耗的n(HCl)=2n(H2)=2×0.005mol=0.01mol,则v(HCl)= =0.025 mol·L-1·min-1;答案为:0.025 mol·L-1·min-1。
=0.025 mol·L-1·min-1;答案为:0.025 mol·L-1·min-1。
(2)A.加入蒸馏水,氢离子浓度减小,反应速率降低,故A可行;
B.加入KCl溶液,相当于稀释,氢离子浓度降低,反应速率降低,故B可行;
C.加入KNO3溶液,相当于含有硝酸,硝酸和Zn反应生成NO而不是氢气,故C不行;
D.加入Na2SO4溶液,相当于稀释,氢离子浓度降低,反应速率降低,故D可行;
答案为C。
(3)①根据图知,随着反应进行,X、Y的物质的量减少而Z的物质的量增加,则X和Y是反应物而Z是生成物,反应达到平衡时,△n(X)=(1.0-0.4)mol=0.6mol、△n(Y)=(1.0-0.8)mol=0.2mol、△n(Z)=(0.5-0.1)mol=0.4mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量变化量之比等于其化学计量数之比,X、Y、Z的化学计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,则该反应方程式为3X(g)+Y(g)2Z(g);答案为3X(g)+Y(g)2Z(g)。
②A.Y的体积分数在混合气体中保持不变,说明各物质的量不变,反应达到平衡状态,故A选;
B.X、Y的反应速率比为3:1时,如果反应速率都是指同一方向的反应速率,则该反应不一定达到平衡状态,故B不选;
C.反应前后气体压强减小,当容器内气体压强保持不变时,各物质的物质的量不变,反应达到平衡状态,故C选;
D.容器内气体的总质量一直保持不变,容器内气体的总质量保持不变不能说明反应达到平衡状态,故D不选;
E.生成1mol Y的同时消耗2mol Z,只表示逆反应,不能说明反应达到平衡状态,故E不选;
答案为AC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
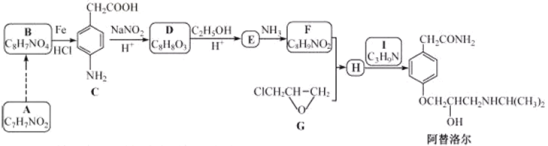
小学生10分钟应用题系列答案【题目】制备钙掺杂纳米Fe3O4,并模拟吸附废水中磷元素的主要实验流程如下:

已知:①CaO2能氧化溶液中的FeCl2,反应生成Fe(OH)3和Fe3+。
②掺杂的Ca2+嵌入Fe3O4中,洗涤时不损失,吸附时不形成Ca3(PO4)2等沉淀。
③溶液的pH对吸附剂表面所带电荷有影响。pH越高,表面所带负电荷越多; pH越低,表面所带正电荷越多。
(1)向FeCl2、FeCl3混合溶液中滴加NaOH溶液,一定条件下反应生成Fe3O4,其离子方程式为___________。
(2)步骤Ⅱ调节pH至11,共沉淀需在70℃条件下进行,适宜的加热方式为________。为提高共沉淀效果,还可采取的措施为_______________。
(3)磷元素的吸附效果、H3PO4水溶液中含磷物种分布分数与pH的关系分别如图1和图2所示。
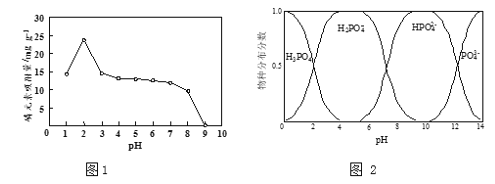
①步骤Ⅳ用KH2PO4溶液模拟废水,测得酸性条件下(pH > 2)对磷元素吸附量较大,原因是:pH越低,吸附剂表面所带正电荷越多,有利于吸附阴离子;___________________
②步骤Ⅴ将吸附剂取出,用碱液解吸回收磷。结合表中数据,分析钙掺杂纳米Fe3O4吸附剂与其他类型吸附剂相比的优势有:________。
不同类型吸附剂对磷酸盐吸附能力比较
吸附剂 | 本产品 | 纯Fe3O4 | 陶瓷材质 |
吸附量/mg·g-1 | 24.1 | 5.0 | 12.5 |
(4)请设计从步骤Ⅱ反应结束后的烧瓶中获取钙掺杂纳米Fe3O4产品的实验方案:用磁铁将沉淀物和溶液分离,______________,用筛网筛分得到产品 (实验中须使用的试剂和仪器有:蒸馏水、无水乙醇、pH计、研钵、烘箱)。
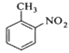
【题目】对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
![]()
![]()
![]() +
+ +
+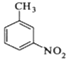
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是___________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于________层(填“上”或'下”)。
(3)5% NaHCO3溶液洗涤的目的是__________
(4)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂)/n(甲苯) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为_______________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_____________。