题目内容
(6分)金属铜的提炼多从黄铜矿开始。黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O2= +2FeS+SO2,(方程式已配平)
+2FeS+SO2,(方程式已配平)
(1)方框中的物质应为_________
(2)若有1 molSO2 生成,则反应中电子转移数目为____ _____
(3)SO2是 产物。
 +2FeS+SO2,(方程式已配平)
+2FeS+SO2,(方程式已配平)(1)方框中的物质应为_________
(2)若有1 molSO2 生成,则反应中电子转移数目为____ _____
(3)SO2是 产物。
(6分) (1).Cu2S (2). 6NA (3).氧化
(1)根据原子守恒可知,该物质是由2个铜原子和1个S原子形成的,所以是Cu2S。
(2)根据方程式可知,每消耗2molCuFeS2,其中被氧化的S元素是1mol,所以失去电子的物质的量是[4-(-2)]mol=6mol,因此转移电子的数目是6NA。
(3)SO2是还原剂中的S元素氧化而产生的,所以是氧化产物。
(2)根据方程式可知,每消耗2molCuFeS2,其中被氧化的S元素是1mol,所以失去电子的物质的量是[4-(-2)]mol=6mol,因此转移电子的数目是6NA。
(3)SO2是还原剂中的S元素氧化而产生的,所以是氧化产物。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
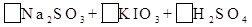 —
— 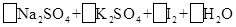

 2Fe+3CO2,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )
2Fe+3CO2,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )