题目内容
(12分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2 – 2e- = 2H+ + O2↑ 还原反应:MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
(1)写出该氧化还原反应的离子方程式: 。
(2)反应中氧化剂是 ;氧化产物是 ;若有0.5molH2O2参加此反应,电子一转移个数为 。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为 ;这时若有0.5molH2O2发生分解,电子转移个数为 。
氧化反应:H2O2 – 2e- = 2H+ + O2↑ 还原反应:MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
(1)写出该氧化还原反应的离子方程式: 。
(2)反应中氧化剂是 ;氧化产物是 ;若有0.5molH2O2参加此反应,电子一转移个数为 。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为 ;这时若有0.5molH2O2发生分解,电子转移个数为 。
(1)2MnO4- +5H2O2+6H+ =2Mn2+ +8H2O+5O2↑
(2)KMnO4 O2 NA (3)2H2O2=2H2O+ O2↑ 0.5 NA
(2)KMnO4 O2 NA (3)2H2O2=2H2O+ O2↑ 0.5 NA
(1)根据已知的还原反应和氧化反应以及电子得失守恒可知,反应的离子方程式为2MnO4- +5H2O2+6H+ =2Mn2+ +8H2O+5O2↑。
(2)高锰酸钾中锰元素的化合价从+7价降低到+2价,所以高锰酸钾是氧化剂。双氧水中氧元素从-1价升高到0价,失去2个电子,因此氧化产物是氧气。有0.5molH2O2参加此反应,转移电子是0.5mol×2=1.0mol,个数是NA。
(3)双氧水分解的方程式为2H2O2=2H2O+ O2↑。在双氧水的分解中每生成1mol氧气,转移2mol电子,消耗2mol双氧水,所以若有0.5molH2O2发生分解,电子转移个数为0.5NA.
(2)高锰酸钾中锰元素的化合价从+7价降低到+2价,所以高锰酸钾是氧化剂。双氧水中氧元素从-1价升高到0价,失去2个电子,因此氧化产物是氧气。有0.5molH2O2参加此反应,转移电子是0.5mol×2=1.0mol,个数是NA。
(3)双氧水分解的方程式为2H2O2=2H2O+ O2↑。在双氧水的分解中每生成1mol氧气,转移2mol电子,消耗2mol双氧水,所以若有0.5molH2O2发生分解,电子转移个数为0.5NA.

练习册系列答案
相关题目
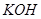 溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的混合溶液。若反应过程中转移
溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的混合溶液。若反应过程中转移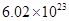 个电子,所得溶液中
个电子,所得溶液中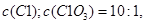 则参与反应的
则参与反应的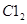 的物质的量为( )
的物质的量为( )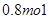
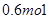
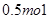
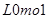
 +2FeS+SO2,(方程式已配平)
+2FeS+SO2,(方程式已配平)