题目内容
10.希腊化学家提出了电解合成氨的新思路,采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了常温常压下高转化率的电解法合成氨.与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图所示是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol•L-1的CuSO4溶液;请回答下列问题:
(1)甲池中通入乙醇的电极Pt作电源的负极.该极的电极反应式C2H5OH-12e-+16OH-═2CO32-+11H2O.
(2)N的电极反应式为4OH--4e-=O2↑+2H2O.
(3)丙池中Pt电极A是阴极(填“阳”或“阴”),该极上的电极反应式是N2+6e-+6H+=2NH3.
(4)丁池是模拟工业上用电渗析法生产HI示意图.写出阴极的电极反应式:Ix-+(x-1)e-=xI-.
(5)若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇4.6g.
分析 (1)甲池为燃料电池,其中氧气为正极反应物,燃料乙醇为负极反应物失电子发生氧化反应;
(2)电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,和电源的负极相连的是阴极,该极上发生得电子的还原反应;
(3)根据图示Pt电极A与负极乙醇相连可知Pt电极A是阴极,阴极上发生得电子的还原反应来回答;
(4)依据图象中阴极上的离子变化可知是Ix-得到电子生成I-;结合电荷守恒、原子守恒配平电极反应;
(5)根据电极反应式结合电子守恒来计算.
解答 解:(1)甲池为燃料电池,其中氧气为正极反应物,燃料乙醇为负极反应物,乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:C2H5OH-12e-+16OH-=2CO32-+11H2O,
故答案为:负;C2H5OH-12e-+16OH-=2CO32-+11H2O;
(2)燃料电池的正极上是氧气发生得电子的还原反应,电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,所以N是阳极,该极上电极反应为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(3)根据图示Pt电极A与负极乙醇相连可知Pt电极A是阴极,阴极发生得电子的还原反应,即N2+6e-+6H+=2NH3,故答案为:阴;N2+6e-+6H+=2NH3;
(4)图象中阴极上的离子变化可知是Ix-得到电子生成I-;结合电荷守恒、原子守恒配平电极反应为:Ix-+(x-1)e-=xI-,故答案为:Ix-+(x-1)e-=xI-;
(5)乙池中发生的反应分别是:阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,2H++2e-=H2↑,100mL3.00mol•L-1的CuSO4溶液中铜离子物质的量是:0.3mol,铜离子得电子的是0.6mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+0.6=4n,解得n=0.3,即装置在转移电子的物质的量是1.2mol,乙醇燃料电池的负极上发生反应:C2H6O+16OH--12e-=2CO32-+11H2O,当转移电子是1.2mol,消耗乙醇的物质的量是0.1mol,质量是0.1mol×46g/mol=4.6g,
故答案为:4.6.
点评 本题考查了原电池和电解池原理,根据反应的自发性确定原电池和电解池,再结合转移电子相等进行解答,题目难度不大.

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | 乙烯的结构简式CH2CH2 | B. | 聚丙烯的结构简式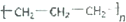 | ||
| C. | 羟基的结构简式 | D. | 3-甲基-1-丁烯的键线式 |
| A. | 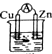 乙醇 | B. |  稀H2SO4 | C. |  稀HCl | D. |  稀H2SO4 |

| A. | 甲装置中电能转化为化学能 | |
| B. | 两个装置中铜片表面均有气泡产生 | |
| C. | 甲装置中铜片表面发生了还原反应 | |
| D. | 甲装置中负极上发生的电极反应为Fe-3e-═Fe3+ |
(1)有机物均含碳元素,甲烷为最简单的有机物.检验甲烷完全燃烧后的产物需用的试剂为澄清石灰水、无水硫酸铜(填试剂名称).
(2)硅为无机非金属材料的主角,写出二氧化硅的一种工业用途制光导纤维.
(3)亚锡离子(Sn2+)与Fe3+反应生成Sn4+,反应的离子方程式为Sn2++2Fe3+=Sn4++2Fe2+
(4)PbO2为褐色粉末,随温度升高会逐步分解:PbO2→PbxOx→PbO(PbxOy表示不同温度下铅的氧化物的化学式).
己知,23.90gPbO2在不同温度下残留固体(均为纯净物)的质量见表
| 温度/℃ | T1 | T2 | T3 | T4 |
| 残留固体质量/g | 23.90 | 23.10 | 22.94 | 22.30 |
 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验的到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验的到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A. | 在恒温恒容条件下,向已达到平衡的体系中加入少量Z,平衡正向移动,Z的含量增大 | |
| B. | 升高温度,正、逆反应速率都增大,平衡常数增大 | |
| C. | △H<0 m+n>c | |
| D. | △H>0 m+n<c |
| A. | 原子半径:W>X>Y>Z | |
| B. | 单质与盐酸反应速率:Y>W | |
| C. | X最低价氢化物的稳定性强于Z最低价氢化物 | |
| D. | 原子序数:X>W>Y>Z |
| A. | CuSO4溶液 | B. | NaOH溶液 | C. | Fe(OH)3胶体 | D. | HCl溶液 |
 图是X、Y、Z三种物质的溶解度曲线,
图是X、Y、Z三种物质的溶解度曲线,