题目内容
5.元素周期表中ⅣA族的元素又称为碳族元素.包含碳、硅、锗(Ge)、锡(Sn)和铅(Pb).同一主族元素的结构和性质具有相似性和递变性.(1)有机物均含碳元素,甲烷为最简单的有机物.检验甲烷完全燃烧后的产物需用的试剂为澄清石灰水、无水硫酸铜(填试剂名称).
(2)硅为无机非金属材料的主角,写出二氧化硅的一种工业用途制光导纤维.
(3)亚锡离子(Sn2+)与Fe3+反应生成Sn4+,反应的离子方程式为Sn2++2Fe3+=Sn4++2Fe2+
(4)PbO2为褐色粉末,随温度升高会逐步分解:PbO2→PbxOx→PbO(PbxOy表示不同温度下铅的氧化物的化学式).
己知,23.90gPbO2在不同温度下残留固体(均为纯净物)的质量见表
| 温度/℃ | T1 | T2 | T3 | T4 |
| 残留固体质量/g | 23.90 | 23.10 | 22.94 | 22.30 |
分析 (1)甲烷完全燃烧生成二氧化碳和水,实验室常用澄清石灰水检验二氧化碳,用无水硫酸铜检验水;
(2)二氧化硅的工业用途是制光导纤维;
(3)亚锡离子和铁离子发生氧化还原反应生成亚铁离子和Sn4+,根据反应物和生成物书写离子方程式;
(4)T2℃和T3℃时的PbxOy质量分别是23.10g、22.94g,反应过程中变化的质量是O元素质量,23.90gPbO2的物质的量=$\frac{23.9g}{239g/mol}$=0.1mol根据化学式知,n(Pb)=0.1mol、n(O)=0.2mol,T1℃-T2℃中固体减少n(O)=$\frac{(23.90-23.10)g}{16g/mol}$=0.05mol,则还剩余n(O)=0.2mol-0.05mol=0.15mol;
T2℃-T3℃中固体减少n(O)=$\frac{(23.10-22.94)g}{16g/mol}$=0.01mol,则还剩余n(O)=0.2mol-0.05mol-0.01mol=0.14mol;
T3℃-T4℃中固体减少n(O)=$\frac{(22.94-22.30)g}{16g/mol}$=0.04mol,则还剩余n(O)=0.2mol-0.05mol-0.01mol-0.04mol=0.1mol;
同一化学式中,各元素物质的量之比等于原子个数之比,据此分析解答.
解答 解:(1)甲烷完全燃烧生成二氧化碳和水,实验室常用澄清石灰水检验二氧化碳,二氧化碳能使澄清石灰水变浑浊,用无水硫酸铜检验水,水蒸气能使无水硫酸铜变蓝色,
故答案为:澄清石灰水;无水硫酸铜;
(2)二氧化硅的工业用途是制光导纤维,故答案为:光导纤维;
(3)亚锡离子和铁离子发生氧化还原反应生成亚铁离子和Sn4+,根据反应物和生成物书写离子方程式为Sn2++2Fe3+=Sn4++2Fe2+,
故答案为:Sn2++2Fe3+=Sn4++2Fe2+;
(4)T2℃和T3℃时的PbxOy质量分别是23.10g、22.94g,反应过程中变化的质量是O元素质量,23.90gPbO2的物质的量=$\frac{23.9g}{239g/mol}$=0.1mol根据化学式知,n(Pb)=0.1mol、n(O)=0.2mol,T1℃-T2℃中固体减少n(O)=$\frac{(23.90-23.10)g}{16g/mol}$=0.05mol,则还剩余n(O)=0.2mol-0.05mol=0.15mol,同一化学式中,各元素物质的量之比等于原子个数之比,则Pb、O原子个数之比=0.1mol:0.15mol=2:3,该氧化物化学式为Pb2O3;
T2℃-T3℃中固体减少n(O)=$\frac{(23.10-22.94)g}{16g/mol}$=0.01mol,则还剩余n(O)=0.2mol-0.05mol-0.01mol=0.14mol,则Pb、O原子个数之比=0.1mol:0.14mol=5:7,该氧化物化学式为Pb5O7;
T3℃-T4℃中固体减少n(O)=$\frac{(22.94-22.30)g}{16g/mol}$=0.04mol,则还剩余n(O)=0.2mol-0.05mol-0.01mol-0.04mol=0.1mol,则Pb、O原子个数之比=0.1mol:0.1mol=1:1,该氧化物化学式为PbO;
则T2℃-T3℃发生的化学反应方程式为Pb5O7$\frac{\underline{\;加热\;}}{\;}$5PbO+O2↑,
故答案为:Pb2O3;Pb5O7;Pb5O7$\frac{\underline{\;加热\;}}{\;}$5PbO+O2↑.
点评 本题考查元素化合物知识,为高频考点,涉及物质检验、化学式判断等知识点,知道常见气体检验方法及现象,难点是(4)题化学式确定,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 称取12.5g胆矾(CuSO4•5H2O),配成500mL溶液 | |
| B. | 称取12.5g胆矾(CuSO4•5H2O),加入500mL水配成溶液 | |
| C. | 称取7.68g无水硫酸铜粉末,加入480mL水配成溶液 | |
| D. | 称取8.0g无水硫酸铜粉末,加入500mL水配成溶液 |
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ⑧ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑨ |
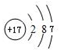 .
.(2)最活泼的金属元素是K(填元素符号,下同);化学性质最稳定的元素是Ne.
(3)第三周期元素形成的气态氢化物中,最稳定的氢化物是HCl(填化学式).
(4)①的最高价氧化物中化学键的类型属于共价键.
(5)用电子式表示④与⑥组成的A2B型化合物的形成过程:
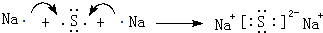 .
.(6)⑤的最高价氧化物属于两性氧化物,它与氢氧化钠反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(7)②的单质与H2反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
| A. | 实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 | |
| B. | 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫 | |
| C. | 将稀盐酸逐滴加入到Na2CO3溶液中,开始无二氧化碳放出 | |
| D. | 可用碳酸钠与醋酸制取少量二氧化碳 |
| A. | Mg2+、NO3-、NH4+ | B. | Na+、K+、CO32- | C. | Fe3+、S042-、Cl- | D. | CH3COO-、Na+、H+ |
| A. | CO2和SiO2 | B. | C60和晶体硅 | C. | KCl和HCl | D. | CO2和H2O |
| A. | 正反应是放热反应 | |
| B. | 当混合气体的平均相对分子质量不变时反应达到平衡 | |
| C. | 当2v正(B)=v逆(C)时,反应达到平衡 | |
| D. | 恒温恒容时,当体系的压强保持不变时,反应一定达到了平衡 |

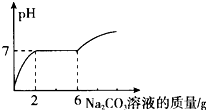 在烧杯中盛有10g HCl和BaCl2的混合溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液.测得溶液pH与加入的碳酸钠溶液的质量关系如图所示.
在烧杯中盛有10g HCl和BaCl2的混合溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液.测得溶液pH与加入的碳酸钠溶液的质量关系如图所示.