题目内容
18.将纯铁片和纯钢片按如图所示插入同浓度的稀硫酸中一段时间,下列说法正确的是( )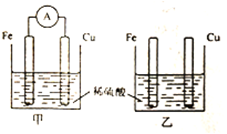
| A. | 甲装置中电能转化为化学能 | |
| B. | 两个装置中铜片表面均有气泡产生 | |
| C. | 甲装置中铜片表面发生了还原反应 | |
| D. | 甲装置中负极上发生的电极反应为Fe-3e-═Fe3+ |
分析 甲中形成铜铁原电池,铁作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Fe+H2SO4=FeSO4+H2↑.乙装置中只是铁片与稀硫酸间发生了置换反应:Fe+H2SO4=FeSO4+H2↑,以此进行分析.
解答 解:A.甲中形成铜铁原电池,将化学能转化为电能,故A错误;
B.甲中形成铜铁原电池,铁作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生乙中不构成原电池,铁片与稀硫酸间发生了置换反应:Fe+H2SO4=FeSO4+H2↑,铁片上有气泡,故B错误;
C.甲中形成铜铁原电池,铁作负极,失电子,铜作正极得电子发生还原反应,故C正确;
D.甲能形成原电池,铁作负极,失电子,反应为Fe-2e-═Fe2+,故D错误;
故选C.
点评 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
8.用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落.下列关于上述实验现象的解释不正确的是( )
| A. | 铝在空气中能很快形成氧化膜 | B. | 用酸处理时未能将氧化膜溶解 | ||
| C. | 氧化铝的熔点比铝高 | D. | 氧化铝薄膜包住了熔化的铝 |
6.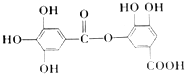 有一种有机化合物,其结构简式如图所示,下列有关它的性质的叙述中,正确的是( )
有一种有机化合物,其结构简式如图所示,下列有关它的性质的叙述中,正确的是( )
 有一种有机化合物,其结构简式如图所示,下列有关它的性质的叙述中,正确的是( )
有一种有机化合物,其结构简式如图所示,下列有关它的性质的叙述中,正确的是( )| A. | 有弱酸性,1mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与6mol NaOH完全反应 | |
| C. | 在Ni催化下,1mol该物质可以和7mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
13.下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是( )
| A. | 实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 | |
| B. | 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫 | |
| C. | 将稀盐酸逐滴加入到Na2CO3溶液中,开始无二氧化碳放出 | |
| D. | 可用碳酸钠与醋酸制取少量二氧化碳 |
7. 已知元素X,Y,Z在周期表中的相对位置如图所示,Y元素基态原子的价电子排布为nsn-1npn+1,则下列说法错误的是( )
已知元素X,Y,Z在周期表中的相对位置如图所示,Y元素基态原子的价电子排布为nsn-1npn+1,则下列说法错误的是( )
 已知元素X,Y,Z在周期表中的相对位置如图所示,Y元素基态原子的价电子排布为nsn-1npn+1,则下列说法错误的是( )
已知元素X,Y,Z在周期表中的相对位置如图所示,Y元素基态原子的价电子排布为nsn-1npn+1,则下列说法错误的是( )| A. | X元素所在周期中所含非金属元素最多 | |
| B. | Z元素基态原子的核外电子排布式为[Ar]3d104s24p3 | |
| C. | Y的氧化物空间构型可能为V型 | |
| D. | 三种元素的最高价氧化物对应水化物酸性最强的是X |
 .
.

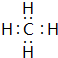 .稳定性最强的结构式为
.稳定性最强的结构式为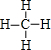 .
.
 ,试写出下列烷烃的分子式.
,试写出下列烷烃的分子式.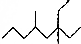 C12H26;
C12H26; C7H14;
C7H14; C8H8;
C8H8; C10H12.
C10H12.