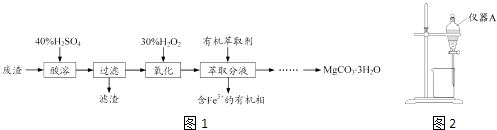
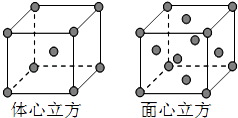
��Ŀ����
����Ŀ����Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ϊʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ����ԣ�
ʵ�� | �Լ� | ���� | |
�ι� | �Թ� | ||
| 0.2 molL��1 Na2SO3��Һ | ����Ag2SO4��Һ | ������ɫ���� |
0.2 molL��1 CuSO4 | ����Һ���̣������μӲ����ػ�ɫ���� | ||
0.1 molL��1 Al2��SO4��3��Һ | ��ʼ�����Ա仯�������μӲ�����ɫ���� | ||
��1�������飬������еİ�ɫ������Ag2SO3 �� �����ӷ���ʽ��������� ��
��2�������飬�������ػ�ɫ�����в���SO42�� �� ����Cu+��Cu2+��SO32�� ��
��֪��Cu+ ![]() Cu+Cu2+ �� Cu2+
Cu+Cu2+ �� Cu2+ ![]() CuI������ɫ��+I2 ��
CuI������ɫ��+I2 ��
����ϡ����֤ʵ�����к���Cu+��ʵ�������� ��
��ͨ������ʵ��֤ʵ�������к���Cu2+��SO32�� �� 
a����ɫ����A��BaSO4 �� �Լ�1�� ��
b��֤ʵ�����к���Cu2+��SO32���������� ��
��3����֪��Al2��SO3��3��ˮ��Һ�в����ڣ������飬�����İ�ɫ��������SO42�� �� �ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ��
���Ʋ�����к������������ ��
�ڶ��ڳ�������������Ĵ�����ʽ������ּ��裺i����Al��OH��3��������ii�����������ļ�ʽ���У��Լ���ii����˶Ա�ʵ�飬֤ʵ�˼���ii������
a�����Ա�ʵ�鷽������������
����һ�� 
�����������ͼ��ʽ���֣���
b������ii������ʵ��֤����
��4������ʵ�飬�������ε������� �� ����Һ�䷴Ӧ�Ķ��������йأ�
���𰸡�
��1��2Ag++SO32��=Ag2SO3��
��2��������ɫ���壻HCl��BaCl2��Һ����I���������£�Cu2+ת��Ϊ��ɫ����CuI��SO32��ת��ΪSO42��
��3��Al3+��OH����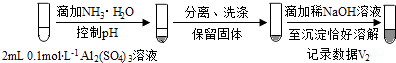 ��V1���Դ���V2
��V1���Դ���V2
��4���ܽ��ԡ���ԭ�ԡ���ˮ��Һ�гʼ��ԣ���������Һ�����������ӵ����ʺͷ�Ӧ����
���������⣺��1��ʵ�����0.2mol/LNa2SO3��Һ���뱥��Ag2SO4��Һ������Ag2SO4������Һ����Һ��Ϻ�ϡ�ͣ���˲�������Ag2SO4����������SO32��Ũ�Ƚϴ�����ƶϰ�ɫ����ΪAg2SO3 �� ��Ӧ�����ӷ���ʽΪ��2Ag++SO32��=Ag2SO3�����ʴ�Ϊ��2Ag++SO32��=Ag2SO3������2�������ݷ�ӦCu+��ϡ���ᷴӦͭ��ͭ���ӣ��������к���Cu+ �� ����ϡ����ᷢ���绯��Ӧ����ͭ���ʣ�ʵ���������к�ɫ�������ɣ��ʴ�Ϊ��������ɫ���壻��a������ʵ�����̿�֪ʵ��ԭ��Ϊ2Cu2++4I��=2CuI+I2��I2+SO32��+H2O=SO42��+2I��+2H+��SO42��+Ba2+=BaSO4��������BaSO4������֪��������Լ�Ϊ��Ba2+�Ļ��������ѡ��BaCl2��Һ�����dz���Aû��BaSO3 �� ���Ӧ�����Ի����У�
�ʴ�Ϊ��HCl��BaCl2��Һ��
b���ɰ�ɫ����A��֪֮ǰ��ȡ�ϲ���Һ����SO42�� �� �ɼ���KI���ɰ�ɫ������֪�ػ�ɫ�����к���Cu2+ �� Cu2+��I����������CuI��ɫ�������ɼӵ���������˵���ϲ���Һ����I2 �� ��Cu2+��I����Ӧ����I2 �� ����ƶ����ɵ�I2������������Ӧ������л�ԭ��SO32����
�ʴ�Ϊ���ػ�ɫ������KI��Һ��Ӧ���ɰ�ɫ������CuI����֤������Cu2+ �� ��ɫ����AΪ���ᱵ��֤������SO32������3���ٸ�������֪ʵ���İ�ɫ��������SO42�� �� �ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ�������Ʋ�����к���Al3+��OH�� �� ��ʹ����KMnO4��Һ��ɫ����Ϊ�����л�ԭ�Ե�����������ӣ�
�ʴ�Ϊ��Al3+��OH�����ڸ��ݼ����֪ʵ���Ŀ����֤�������ij�����Al��OH��3�������ļ�ʽ�Σ�����ʵ�������Ʊ���������еij�����Ȼ����õμ�NaOH��Һ����˶Ա�ʵ������Ҫ�Ʊ���Al��OH��3������Ȼ��μ�NaOH��Һ�����������ĵ�NaOH�����ͬ����������еij�������Al��OH��3���������������ĵ�NaOH�����ͬ����������еij������������ļ�ʽ�Σ�
���ļ�ʽ�κ�NaOH��Һ��Ӧ�൱�������Ӻ�NaOH��Ӧ����Ӧ����Ϊ1��4����Al��OH��3��NaOH��Ӧ����Ϊ1��1�������V1���Դ���V2 �� �����ii��������V1=V2 �� �����i������
�ʴ�Ϊ��a��  ��
��
b������ii������ʵ��֤����V1���Դ���V2 ��
�ʴ�Ϊ��V1���Դ���V2����4����Ŀ���жദ��ʾ���ǻ�ԭ�ԣ����磨3���еij�������ʹ���Ը��������ɫ���ڶ��գ�ʵ�����Ҫ����ʵ��Ŀ�ģ�������Ŀ������̽������ Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ӧ�����Եõ����ۣ�����Һ�䷴Ӧ�Ķ���������������Һ�����������ӵ����ʺͷ�Ӧ�����йأ�
�ʴ�Ϊ����ԭ�ԡ�ˮ��ʼ��ԣ���������Һ�����������ӵ����ʺͷ�Ӧ�����йأ�
��1��0.2mol/LNa2SO3��Һ���뱥��Ag2SO4��Һ������Ӧ���ɰ�ɫ����Ag2SO3����2���ٸ��ݵڶ���������2����֪��Ϣ�����Ե�֪��ȡ����ϴ�����ų�Cu2+���ţ����ػ�ɫ�������μ�ϡ���ᣬ������죨ͭ���ʣ�����֤���� Cu+����a������BaSO4������֪��������Լ�Ϊ��Ba2+�Ļ��������ѡ��BaCl2��
b���ɰ�ɫ����A��֪֮ǰ��ȡ�ϲ���Һ����SO42�� �� �ɼ���KI���ɰ�ɫ������֪�ػ�ɫ�����к���Cu2+ �� Cu2+��I����������CuI��ɫ�������ɼӵ���������˵���ϲ���Һ����I2 �� ��Cu2+��I����Ӧ����I2 �� ����ƶ����ɵ�I2������������Ӧ������л�ԭ��SO32������3���������⣬��ɫ������������ǿ�ᣬ��������ǿ����Եõ������к���Al3+��OH�� �� ��ʹ����KMnO4��Һ��ɫ����Ϊ�����л�ԭ�Ե�����������ӣ��ڸ���ʵ��Ŀ�ĺͶԱ�ʵ�����ԭ�����н�𣻣�4������ʵ�飬�������ξ����ܽ��ԡ���ԭ�ԡ�ˮ��ʼ��ԣ�����Һ�䷴Ӧ�Ķ���������������Һ�����������ӵ����ʺͷ�Ӧ�����йأ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�������ϡ��ķ��ֺ�ʹ�������Ἣ����ƶ�����������ķ�չ��һЩ���ϵij�������������̱�ʽ��ʱ�������壮��ش��������⣺
��1����ʯ�ޣ�CaMg3Si4O12���dz��õ��ͻ���ϣ������������ʽ��ʾ����� ��
��2����ij���ǻҵijɷ�Ϊ��
�� �� | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
�������� | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
ͨ����ͼ���̿��ɵ��ǻ��Ʊ��ϴ����Ķ������裮
��ش��������⣺
��������������ʽ��з��࣬���ǻ����漰��������������࣮
��3����������漰SiO2�����ӷ�Ӧ����ʽΪ ��
��4������A�ijɷ������ѧʽ��
��5�������ϴ�ӳ����ķ����ǣ�
��6������۷�Ӧ�Ļ�ѧ����ʽΪ����ʵ���ҽ��в�����õ������������������ƾ��ơ������Ǽܣ�