��Ŀ����
����Ŀ�������ϡ��ķ��ֺ�ʹ�������Ἣ����ƶ�����������ķ�չ��һЩ���ϵij�������������̱�ʽ��ʱ�������壮��ش��������⣺
��1����ʯ�ޣ�CaMg3Si4O12���dz��õ��ͻ���ϣ������������ʽ��ʾ����� ��
��2����ij���ǻҵijɷ�Ϊ��
�� �� | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
�������� | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
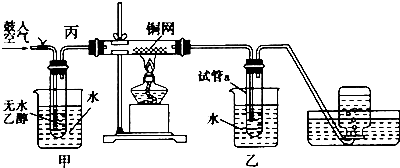
ͨ����ͼ���̿��ɵ��ǻ��Ʊ��ϴ����Ķ������裮
��ش��������⣺
��������������ʽ��з��࣬���ǻ����漰��������������࣮
��3����������漰SiO2�����ӷ�Ӧ����ʽΪ ��
��4������A�ijɷ������ѧʽ��
��5�������ϴ�ӳ����ķ����ǣ�
��6������۷�Ӧ�Ļ�ѧ����ʽΪ����ʵ���ҽ��в�����õ������������������ƾ��ơ������Ǽܣ�
���𰸡�
��1��CaO?3MgO?4SiO2
��2��3
��3��SiO2+2OH��=SiO32��+H2O
��4��C��Fe2O3
��5����©����ij�����ע������ˮ��ˮ��û����,��ˮ��Ȼ����,�ظ�2��3��
��6��H2SiO3![]() SiO2+H2O�������ǣ�����ǯ
SiO2+H2O�������ǣ�����ǯ
���������⣺��ʯ�ޣ�CaMg3Si4O12���dz��õ��ͻ���ϣ������������ʽ��ʾ����ɣ���д˳���ǣ����ý���Ԫ��������ϻ��ý���Ԫ��������������衢ˮ������Ϊ��CaO3MgO4SiO2��
���Դ��ǣ�CaO3MgO4SiO2��
��2����������Ϊ��������������ơ�������Ϊ���������������Ϊ�����������������漰3�������
���Դ��ǣ�3����3����������Ϊ������������������Ʒ�Ӧ���ɹ����ƺ�ˮ�����ӷ���ʽΪSiO2+2OH��=SiO32��+H2O��
���Դ��ǣ�SiO2+2OH��=SiO32��+H2O����4�������ơ������ؾ�����ˮ��Ӧ���ɿ����Լ������Ϊ�����������ܹ���ǿ�Ӧ���ɿ�����ƫ�����Σ��������� Ϊ�������������������Ʒ�Ӧ���ɿ����Թ����ƣ�������������̼���������Ʋ���Ӧ�����Թ���ʣ�������ΪC��Fe2O3��
���Դ��ǣ�C��Fe2O3����5��������ϴ�ӷ�������©����ע������ˮ��ˮ��û��������ˮ��Ȼ���º����ظ�2��3�Σ�
���Դ��ǣ���©����ij�����ע������ˮ��ˮ��û��������ˮ��Ȼ���£��ظ�2��3�Σ���6������ȶ������ֽ����ɶ��������ˮ���䷴Ӧ����ʽΪ��H2SiO3 ![]() SiO2+H2O�����չ�����Ҫ�������У�����ǯ���ƾ��ơ����żܡ������������ǣ�
SiO2+H2O�����չ�����Ҫ�������У�����ǯ���ƾ��ơ����żܡ������������ǣ�
���Դ��ǣ�H2SiO3 ![]() SiO2+H2O�������ǣ�����ǯ��
SiO2+H2O�������ǣ�����ǯ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ϊʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ����ԣ�
ʵ�� | �Լ� | ���� | |
�ι� | �Թ� | ||
| 0.2 molL��1 Na2SO3��Һ | ����Ag2SO4��Һ | ������ɫ���� |
0.2 molL��1 CuSO4 | ����Һ���̣������μӲ����ػ�ɫ���� | ||
0.1 molL��1 Al2��SO4��3��Һ | ��ʼ�����Ա仯�������μӲ�����ɫ���� | ||
��1�������飬������еİ�ɫ������Ag2SO3 �� �����ӷ���ʽ��������� ��
��2�������飬�������ػ�ɫ�����в���SO42�� �� ����Cu+��Cu2+��SO32�� ��
��֪��Cu+ ![]() Cu+Cu2+ �� Cu2+
Cu+Cu2+ �� Cu2+ ![]() CuI������ɫ��+I2 ��
CuI������ɫ��+I2 ��
����ϡ����֤ʵ�����к���Cu+��ʵ�������� ��
��ͨ������ʵ��֤ʵ�������к���Cu2+��SO32�� �� 
a����ɫ����A��BaSO4 �� �Լ�1�� ��
b��֤ʵ�����к���Cu2+��SO32���������� ��
��3����֪��Al2��SO3��3��ˮ��Һ�в����ڣ������飬�����İ�ɫ��������SO42�� �� �ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ��
���Ʋ�����к������������ ��
�ڶ��ڳ�������������Ĵ�����ʽ������ּ��裺i����Al��OH��3��������ii�����������ļ�ʽ���У��Լ���ii����˶Ա�ʵ�飬֤ʵ�˼���ii������
a�����Ա�ʵ�鷽������������
����һ�� 
�����������ͼ��ʽ���֣���
b������ii������ʵ��֤����
��4������ʵ�飬�������ε������� �� ����Һ�䷴Ӧ�Ķ��������йأ�