题目内容
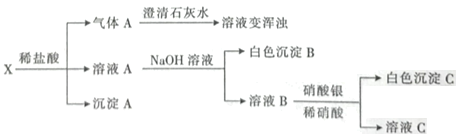
【题目】研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法不正确的是( )
A.负极反应式:Ag+Cl--e-=AgCl
B.正极反应式:5MnO2+2e-= Mn5O102-
C.每生成1 mol Na2Mn5O10转移2 mol电子
D.AgCl是还原产物
【答案】D
【解析】
虽然这个电池总反应比较复杂,标出化合价可以发现![]() 失电子作还原剂,
失电子作还原剂,![]() 得电子作氧化剂,因此
得电子作氧化剂,因此![]() 为电源负极,
为电源负极,![]() 为电源正极,据此来分析选项即可。
为电源正极,据此来分析选项即可。
A.根据分析,负极是银,失电子变成氯化银,A项正确;
B.根据分析,正极是![]() ,得电子变成
,得电子变成![]() ,B项正确;
,B项正确;
C.每生成一个![]() ,相当于5个+4价的锰原子变成5个+3.6价的锰原子,故一共失去2mol电子,反应中转移的总电子数等于氧化剂得电子数,C项正确;
,相当于5个+4价的锰原子变成5个+3.6价的锰原子,故一共失去2mol电子,反应中转移的总电子数等于氧化剂得电子数,C项正确;
D.根据化合价不难发现![]() 是单质银化合价升高后得到的产物,即氧化产物,D项错误;
是单质银化合价升高后得到的产物,即氧化产物,D项错误;
答案选D。

练习册系列答案
相关题目
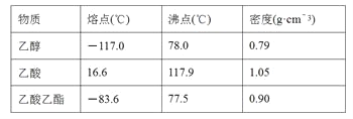
【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D. =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度