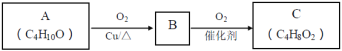
题目内容
【题目】铯(Cs)在自然界中只有一种稳定同位素![]() Cs,核泄漏事故中会产生人工放射性同位素
Cs,核泄漏事故中会产生人工放射性同位素![]() Cs、
Cs、![]() Cs。下列有关说法正确的是
Cs。下列有关说法正确的是
A.铯元素的相对原子质量约为133B.![]() Cs、
Cs、![]() Cs的性质相同
Cs的性质相同
C.![]() Cs的电子数为79D.
Cs的电子数为79D.![]() Cs、
Cs、![]() Cs互为同素异形体
Cs互为同素异形体
【答案】A
【解析】
A.元素的相对原子质量是依照该元素在自然界中的稳定同位素的质量计算的,铯(Cs)在自然界中只有一种稳定同位素![]() Cs,则铯元素的相对原子质量约为133,A正确;
Cs,则铯元素的相对原子质量约为133,A正确;
B.![]() Cs、
Cs、![]() Cs的质子数相同,而中子数不同,二者互为同位素,同位素的化学性质相同,但物理性质有差别,B错误;
Cs的质子数相同,而中子数不同,二者互为同位素,同位素的化学性质相同,但物理性质有差别,B错误;
C.电子数等于质子数,![]() Cs的质子数为55,则电子数为55,C错误;
Cs的质子数为55,则电子数为55,C错误;
D.![]() Cs、
Cs、![]() Cs是同种元素的不同原子,互为同位素,不是同素异形体,D错误;
Cs是同种元素的不同原子,互为同位素,不是同素异形体,D错误;
故合理选项是A。

【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=__________(用含a的代数式表示)
(2)反应进行到t1时,SO2的体积分数为_______________;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将________(填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量____2.1mol(填“<”、“>”或“=”),简单说明原因:____________。
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆________v正 (填“<”、“>”或“=”)。
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列横线上:
c2______2c1,v1______v2;K1_____K3,p2____2p3;α1(SO2)_____α3(SO2);α2(SO3)+α3(SO2)_______1
【题目】某同学进行SO2的性质实验。在点滴板a、b、c、d处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如表所示。下列说法正确的是( )
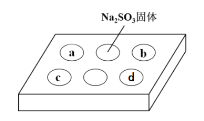
序号 | 试剂 | 实验现象 |
a | 品红溶液 | 红色褪去 |
b | 酸性KMnO4溶液 | 紫色褪去 |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
d | H2S溶液 | 黄色浑浊 |
A.在浓硫酸与Na2SO3固体反应中,浓硫酸表现的强氧化性
B.a、b均表明SO2具有漂白性
C.c中只可能发生反应:SO2+2OH-=SO32-+H2O
D.d中表明SO2具有氧化性
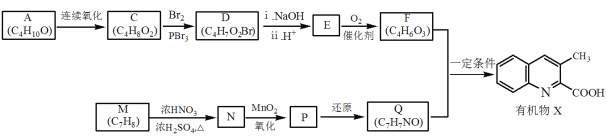
【题目】I.焦炭可用于制备电石、生产水煤气等。完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是___________;其与水反应的化学方程式为______________________。
(2)制备电石还需要用到CaCO3。组成CaCO3的三种元素原子半径按从大到小的顺序排列为____________。氧原子的核外电子排布式为_________________。
(3)与同主族元素Mg相比,Ca的金属性更______(填“强”或者“弱”)。能证明这一结论的实验事实是________________________。
II.用焦炭生产水煤气的反应为:C(s)+H2O(g)![]() CO(g)+H2(g)。完成下列填空:
CO(g)+H2(g)。完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是____________。(选填编号)
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2 L的恒容密闭容器中,进行反应,得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | C | H2 | CO | |||
1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为____________。
②下列图像正确的是________。(选填编号)
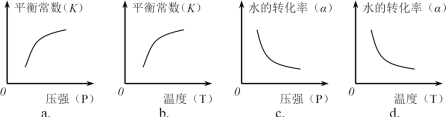
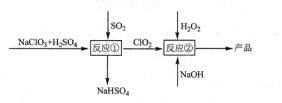
【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯。目前Cl2O、ClO2、Cl2O7已能制取。
有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是____ 酸的酸酐,Cl2O电子式为____________。
(2)下列能判断Cl和O两种元素非金属性强弱的是______(选填编号)。
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是___________________________。
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是________,氧化产物________。(填离子符号)