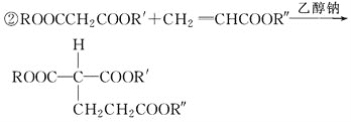题目内容
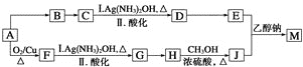
【题目】有机物E的合成路线如图:
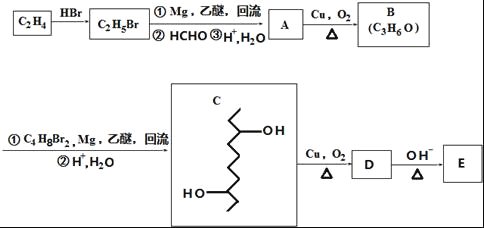
已知:
①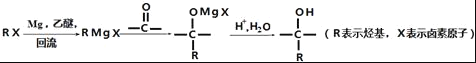
②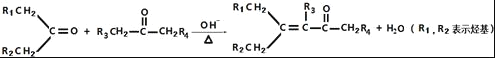
完成下列填空:
(1)B中官能团的名称为_____.C2H4生成C2H5Br的反应类型为____.
(2)C的分子式为_____.
(3)检验C2H5Br分子中含有溴原子的实验方案为____.
(4)E的结构简式为![]() ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
(5)写出一种满足下列条件的有机物的结构简式_____
①分子式只比E少2个氢原子
②与FeCl3发生显色反应
③分子中含有4种不同化学环境的氢原子.
【答案】醛基 加成反应 C10H22O2 取样品少量于洁净试管中,加入NaOH水溶液后加热10分钟、冷却后用稀硝酸酸化、滴入AgNO3溶液,出现淡黄色沉淀  、
、 .
.  或
或
【解析】
根据各物质转化关系,乙烯与溴化氢加成得溴乙烷,溴乙烷与甲醛发生信息①的反应得A为CH3CH2CH2OH,A催化氧化得B为CH3CH2CHO,B发生信息①中的反应得C,C催化氧得D为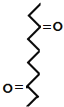 ,D发生信息②中的反应得E为
,D发生信息②中的反应得E为![]() ,据此答题。
,据此答题。
(1)B为CH3CH2CHO,B中官能团的名称为醛基,C2H4生成C2H5Br的反应类型为加成反应;
(2)根据C的结构简式可知,C的分子式为 C10H22O2;
(3)检验C2H5Br分子中含有溴原子的实验方案为取样品少量于洁净试管中,加入NaOH水溶液后加热10分钟、冷却后用稀硝酸酸化、滴入AgNO3溶液,出现淡黄色沉淀;
(4)D为 ,D发生信息②中的反应可以生成E为
,D发生信息②中的反应可以生成E为![]() ,还会生成另两种具有五元环结构的副产物为
,还会生成另两种具有五元环结构的副产物为 、
、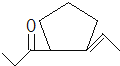 ;
;
(5)E为![]() ,分子式为C10H16O,根据条件①分子式只比E少2个氢原子,即其分子式为C10H14O,不饱和度为4,②与FeCl3发生显色反应,说明有酚羟基,③分子中含有4种不同化学环境的氢原子,则符合条件的有机物的结构简式为
,分子式为C10H16O,根据条件①分子式只比E少2个氢原子,即其分子式为C10H14O,不饱和度为4,②与FeCl3发生显色反应,说明有酚羟基,③分子中含有4种不同化学环境的氢原子,则符合条件的有机物的结构简式为 或
或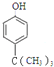 。
。

 53天天练系列答案
53天天练系列答案【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=__________(用含a的代数式表示)
(2)反应进行到t1时,SO2的体积分数为_______________;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将________(填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量____2.1mol(填“<”、“>”或“=”),简单说明原因:____________。
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆________v正 (填“<”、“>”或“=”)。
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列横线上:
c2______2c1,v1______v2;K1_____K3,p2____2p3;α1(SO2)_____α3(SO2);α2(SO3)+α3(SO2)_______1
【题目】某同学查阅资料得知25℃时部分弱酸的电离常数如下表:
酸 | HCOOH | HClO | H2CO3 | H2C2O4 | H2S |
电离常数(Ka) | 1.8×10-4 | 3×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 | K1=1.3×10-7 K2=7.1×10-15 |
据此回答以下几个问题:
(1)四位同学根据表中数据写出以下几个反应方程式
甲:![]()
乙:![]()
丙:![]()
丁:![]()
上述反应可以成功进行的是______(填同学代号)。
(2)甲同学为证明 HCOOH 为弱酸,采用以下方法一定能证明的是_______(填序号)。
①常温下测得HCOONa溶液的pH大于7
②用HCOOH 溶液做导电实验,灯泡很暗
③HCOOH与Na2S能发生反应产生臭鸡蛋气味的气体
④采用pH计测得常温下 0.1 mol/L HCOOH 溶液的pH=1.37
⑤HCOONa和H3PO4反应,生成 HCOOH
⑥pH=2的HCOOH溶液稀释至100倍后,测得pH约为3.4
(3)乙同学取10.00 mL 0.1 mol/L H2C2O4在室温下用0.1 mol/L NaOH 溶液进行滴定,并使用氢离子浓度监测仪进行实时监控,当电脑显示 pH=7并稳定时停止滴定,此时测得消耗NaOH 溶液体积为V mL。
①该实验可使用________量取10.00 mL 0.1 mol/L H2C2O4(填仪器名称)。
②V____10.00 mL(填“>”“="或“<”)。
③滴定结束后溶液中所含离子浓度由大到小为:_________(书写离子浓度符号并用“>”连接)。
④丙同学与甲同学做同样实验。但他将0.1 mol/L H2C2O4换成0.1 mol/L H2S溶液,丙同学实验结束后溶液c(HS-)___ c(S2-)(填">""<"或“=”)。
(4)已知酸性高锰酸钾可将甲酸氧化成二氧化碳,丁采用 HCOOH 溶液对某KMnO4样品进行纯度测定(杂质不参导反应),取0.200 g KMnO4样品(M=158 g/mol)在锥形瓶中溶解并酸化后,用0.100 mol/L的标准HCOOH溶液进行滴定,滴定至终点时消耗 HCOOH 溶液20.00 mL。
①对 KMnO
②确定达到滴定终点的判断方法是_________。
③该样品中KMnO4的纯度为 _______(用百分数表示)。