题目内容
【题目】二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ.某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i. 2NO(g)+Cl2(g)![]() 2ClNO(g) △H1<0其平衡常数为K1
2ClNO(g) △H1<0其平衡常数为K1
ii. 2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=_______(用K1、K2表示),反应热△H3=_____(用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=_______(用K1、K2表示),反应热△H3=_____(用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:10min内υ(ClNO) =___________________,平衡常数K2=_________________;
II.除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是______________。
A.c(Na+) = c(HSO3-)+ 2c(SO32-)
B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—)
C.2c(Na+) =3c(H2SO3)+3c(HSO3-)+3c(SO32-)
D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3)
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则

①工作一段时间后,阴极区溶液的pH______(填“增大”“减小”或“不变”);
②写出阳极的电极反应式_______________________。
【答案】![]() 2H2-H1 或-(H1-2H2) 2.5×10-3mol·L-1·min-1 10 L/mol AD 增大 HSO3--2e-+H2O=SO42-+3H+
2H2-H1 或-(H1-2H2) 2.5×10-3mol·L-1·min-1 10 L/mol AD 增大 HSO3--2e-+H2O=SO42-+3H+
【解析】
Ⅰ.(1)由i.2NO(g)+Cl2(g)2ClNO(g),ii.2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g),结合盖斯定律可知②×2-①可得:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g);
(2)10min时反应 ii达到平衡,测得平衡时NO2的转化率α1(NO2)=50%,则:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)
开始 0.2 0
转化 0.1 0.05
平衡 0.1 0.05
结合v=![]() 及K为生成物浓度幂之积与反应物浓度幂之积的比计算;
及K为生成物浓度幂之积与反应物浓度幂之积的比计算;
II.除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,c(H+)=c(OH-),结合溶液中的电荷守恒、元素守恒、电离平衡常数分析判断;
(4)①阴极区是溶液中的氢离子放电;
②由装置图可知,右边为亚硫酸根失电子易被氧化为硫酸根,为阳极。
Ⅰ.(1)由i.2NO(g)+Cl2(g)2ClNO(g),ii.2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g),结合盖斯定律可知②×2-①可得:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3=![]() ,反应热△H3=2H2-H1;
,反应热△H3=2H2-H1;
(2)10min时反应 ii达到平衡,测得平衡时NO2的转化率α1(NO2)=50%,则:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)
开始 0.2 0
转化 0.1 0.05
平衡 0.1 0.05
则:10min内υ(ClNO) = =2.5×10-3molL-1min-1,平衡常数K2=
=2.5×10-3molL-1min-1,平衡常数K2=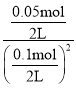 =10L/mol;
=10L/mol;
II.除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,c(H+)=c(OH-);
A.依据溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),得到c(Na+)=c(HSO3-)+2c(SO32-),故A正确;
B.若c(HSO3-)=c(SO32-),溶液呈酸性c(H+)>c(OH-),故B错误;
C.亚硫酸氢钠和亚硫酸钠按照1:1混合,溶液呈碱性,溶液中物料守恒为2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-),但溶液呈中性,亚硫酸氢钠和亚硫酸钠物质的量不相同,故C错误;
D.依据化学式可知,亚硫酸氢钠中硫元素物质的量和钠的物质的量相同,亚硫酸钠中钠离子大于亚硫酸根中硫元素,所以c(Na+)>c(HSO3-)+c(SO32-)+c(H2SO3),故D正确;
故答案为AD;
(4)①电解池中,阴极区是溶液中的氢离子放电,电极反应式为:2H++2e-=H2↑,则pH增大;
②由装置图可知,右边为亚硫酸根失电子易被氧化为硫酸根,为阳极,则电极反应式为HSO3--2e-+2H2O═SO42-+3H+。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现象 | 解释 | |
A | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有 |
B |
|
|
C | 某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
D | 铁加入稀硝酸中有气泡产生 | 铁与稀硝酸发生了置换反应 |
A.AB.BC.CD.D
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D