题目内容
【题目】铁、铝及其化合物在生产和生活中有着广泛的应用。
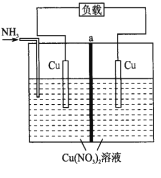
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;装置③中阴极产物为:_____________________。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为:_________________。
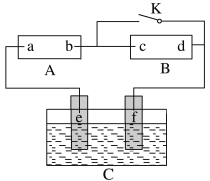
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。


图2电池负极区的电极反应为:_______________;若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现________色,c位置的电极反应式为____________________,若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是___________(填A或B)电极。
【答案】②③ NaOH和H2 CnH2nOn-4ne-+nH2O=nCO2+4nH+ BH4--8e-+8OH-=BO2-+6H2O 红 O2+2H2O+4e-=4OH- B
【解析】
(1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌作负极被腐蚀,铁作正极被保护;③装置为电解池,铁作阴极被保护;
(2)CnH2nOn的电极为负极,电极反应为:CnH2nOn-4ne-+nH2O=nCO2+4nH+;
(3)图2负极是BH4-发生氧化反应;原电池发生吸氧腐蚀,正极是氧气得电子生成大量的氢氧化钠,能使酚酞变红色;若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则阳极放电的是I-离子,反应产生I2,b为阳极,与正极B相连。
(1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌为负极被腐蚀,,Fe作正极被保护;③装置为电解池,铁作阴极被保护;②③装置中铁被保护;装置③中发生的是电解饱和食盐水的反应,阳极是Cl-失电子生成Cl2,阴极是H+得到电子,反应产生H2,H+放电发生还原反应,破坏了附近的水的电离平衡,水进一步电离,最终附近溶液中c(OH-)>c(H+),所以阴极附近溶液中含有大量NaOH,故装置③中阴极产物为:H2、NaOH;
(2)通入CnH2nOn的电极为负极,电极反应为:CnH2nOn-4ne-+nH2O=nCO2+4nH+;
(3)图2燃料电池的负极是BH4-发生氧化反应,电极反应式为BH4--8e-+8OH-=BO2-+6H2O;正极上H2O2获得电子变为OH-,电极反应式为H2O2+2e-=2OH-;若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,构成原电池,则a电极是锌板,锌电极为负极,锌失电子,铅笔芯为正极,O2得电子,在该极生成大量的氢氧化钠,使溶液显碱性,酚酞溶液变为红色;c位置的电极反应式为O2+2H2O+4e-=4OH-;若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则阳极放电的是I-,为阳极,b电极与电源的正极B相连。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案