题目内容
【题目】下列离子方程式能正确描述实验事实的是( )
A. 镁粉加到氯水中,氯水褪色:![]()
B. 双氧水和稀硫酸同时加到84消毒液中,产生大量气泡:![]()
C. ![]() 混和溶液中产生淡黄色沉淀:
混和溶液中产生淡黄色沉淀:![]()
D. 在![]() 溶液中通入
溶液中通入![]() 气,溶液颜色变深:
气,溶液颜色变深:![]()
【答案】B
【解析】
A.所给的离子方程式没有涉及因氯气消耗而使氯水褪色的原因,A项错误;
B.过氧化氢既有氧化性又有还原性,在酸性条件下,被强氧化性的次氯酸氧化为氧气,B项正确;
C.产生淡黄色沉淀是发生了价态归中反应:2S2-+SO32-+6H+=3S↓+3H2O,C项错误;
D. 因I-的还原性强于Fe2+,所以向FeI2中通入氯气,首先发生反应:2I-+Cl2=I2+2Cl-,总反应为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,D项错误;
所以答案选择B项。

【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用Pt/Al2O3、Pd/C、 Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2 (g)+CO(g)CH3OH(g)
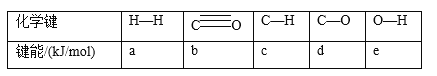
(1)下表所列数据是各化学键的键能,该反应的ΔH=_______(用含字母的代数式表示)。
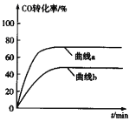
(2)某科研小组用Pd/C作催化剂,在450℃时,研究了n(H):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图),则图中表示n(H2):n(CO)=3:1的变化曲线为______(填“曲线a"或“曲线b”)。
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在2L的恒容密闭容器内充入1 mol CO和2molH2,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,CO的平均反应速率为________,该温度下的平衡常数K为_______.
(4)将CO和H2加入密闭容器中,在一定条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。平衡时CO的体积分数(%)与温度和压强的关系如下图所示(虚线框表示没有测定该条件下的数据)。
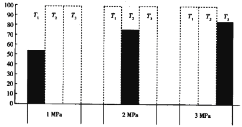
T1、T2、T3由大到小的关系是_________,判断理由是____________
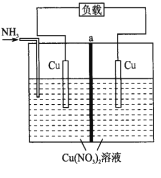
(5)美国的两家公司合作开发了多孔硅甲醇直接燃料电池,其工作原理如图
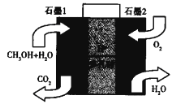
①石墨2为__________ (填“正“或“负“)极。
②石墨1极发生的电极反应式为________
【题目】将![]() 和
和![]() 以
以![]() (体积比)分别通入到体积为2L的恒容密闭容器中进行反应:
(体积比)分别通入到体积为2L的恒容密闭容器中进行反应:![]() ,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
实验 | 温度/℃ | 起始 | 平衡 | 达平衡所需时间/min |
① | 500 | 5.00 | 2.00 | 40 |
② | 800 | 3.00 | 1.00 | 15 |
③ | 500 | 3.00 | 1.20 | 9 |
A. 实验①中,在![]() 内,以
内,以![]() 表示的反应速率大于
表示的反应速率大于![]()
B. 比较实验①和②,不能说明浓度对反应速率的影响
C. 比较实验①和②,不能说明反应速率随温度升高而增大
D. 比较实验②和③,说明实验③使用了催化剂