题目内容
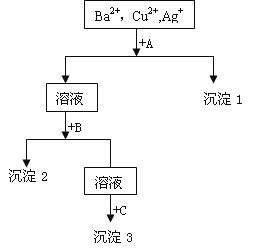
【题目】硫酸镍广泛应用于电镀、电池、催化剂等工业。某科研小组以粗硫酸镍(含Cu2+、Fe3+、Ca2+、Mg2+、Zn2+等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。回答下列问题。

(1)滤渣1的主要成分是__(写化学式),写出“硫化除铜”过程中发生的氧化还原反应的离子方程式___。
(2)“氧化除杂”时加入Cl2和Ni(OH)2的作用分别是___。
(3)已知25℃时,Ksp[CaF2]=3.95×10-11;Ksp[MgF2]=6.40×10-9。则“氟化除杂”过后滤液3中 =__。(保留三位有效数字)
=__。(保留三位有效数字)
(4)“萃取”时使用萃取剂R在硫酸盐中对某些金属离子的萃取率与溶液pH的关系如图。则实验时需控制的pH适宜范围是___(填字母序号)。
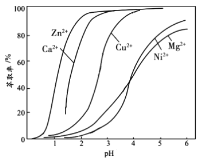
A.1~2 B.3~4 C.4~5 D.5~6
(5)将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为___、___、过滤、洗涤等。
(6)称取2.000g硫酸镍晶体(NiSO4·6H2O)样品溶解,定容至250mL。取25.00mL试液,用0.0200mol·L-1的EDTA(Na2H2Y)标准溶液滴定至终点。重复实验,平均消耗EDTA标准溶液体积为36.50mL。反应为Ni2++H2Y2-=NiY2-+2H+。计算样品纯度为__%。(保留三位有效数字,且不考虑杂质反应)
【答案】CuS和S 2Fe3++H2S=2Fe2++S↓+2H+ Cl2的作用是将滤液中Fe2+氧化为Fe3+,Ni(OH)2的作用是调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去 6.17×10-3 B 蒸发浓缩 降温结晶(或冷却结晶) 96.0
【解析】
由流程图可知,粗硫酸镍(含![]() 等)加水和硫酸进行酸浸溶解,得到含有Ni2+、Cu2+、Fe3+、Ca2+、Mg2+、Zn2+、SO42-等离子的浸出液,向浸出液中通入H2S气体,Cu2+转化为CuS沉淀除去,同时Fe3+可与硫化氢发生氧化还原反应生成Fe2+和S单质,过滤后得到滤液1和滤渣1,滤渣1为CuS和S,滤液1中含有Ni2+、Fe2+、Ca2+、Mg2+、Zn2+、SO42-,向滤液1中加入Ni(OH)2和Cl2,Cl2将滤液中Fe2+氧化为Fe3+,用Ni(OH)2调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去,再进行过滤得到滤液2,向其中加入NiF2,使滤液2中的Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,再次进行过滤得到滤液3,向滤液3中加入有机萃取剂,使滤液3中的Zn2+转移至有机相中分液除去,最后对水溶液进行蒸发浓缩、降温结晶、过滤、洗涤等操作得到产品硫酸镍晶体。
等)加水和硫酸进行酸浸溶解,得到含有Ni2+、Cu2+、Fe3+、Ca2+、Mg2+、Zn2+、SO42-等离子的浸出液,向浸出液中通入H2S气体,Cu2+转化为CuS沉淀除去,同时Fe3+可与硫化氢发生氧化还原反应生成Fe2+和S单质,过滤后得到滤液1和滤渣1,滤渣1为CuS和S,滤液1中含有Ni2+、Fe2+、Ca2+、Mg2+、Zn2+、SO42-,向滤液1中加入Ni(OH)2和Cl2,Cl2将滤液中Fe2+氧化为Fe3+,用Ni(OH)2调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去,再进行过滤得到滤液2,向其中加入NiF2,使滤液2中的Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,再次进行过滤得到滤液3,向滤液3中加入有机萃取剂,使滤液3中的Zn2+转移至有机相中分液除去,最后对水溶液进行蒸发浓缩、降温结晶、过滤、洗涤等操作得到产品硫酸镍晶体。
(1)根据分析可知,向浸出液中通入H2S气体,Cu2+转化为CuS沉淀除去,同时Fe3+可与硫化氢发生氧化还原反应生成Fe2+和S单质,则滤渣1为CuS和S,发生的氧化还原反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,故答案为: CuS和S;2Fe3++H2S=2Fe2++S↓+2H+;
(2)根据分析可知,氧化除杂时加入Cl2的目的是将滤液中Fe2+氧化为Fe3+,用Ni(OH)2调节溶液pH值,使滤液1中的Fe3+转化为氢氧化铁沉淀除去,故答案为:Cl2的作用是将滤液中Fe2+氧化为Fe3+,Ni(OH)2的作用是调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去;
(3)已知![]() 时,
时,![]() ;
;![]() ,则“氟化除杂”过后滤液3中
,则“氟化除杂”过后滤液3中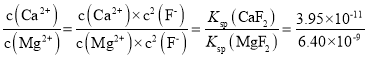 =6.17×10-3,故答案为:6.17×10-3;
=6.17×10-3,故答案为:6.17×10-3;
(4)在该工艺流程中,“萃取”操作的目的是使滤液3中的Zn2+转移至有机相中分液除去,流程的最终目的是制得硫酸镍,结合金属离子的萃取率与溶液![]() 的关系如图所示,当控制实验时的
的关系如图所示,当控制实验时的![]() 为3~4左右可以使滤液中的Zn2+等离子的萃取除杂率最好,B正确,故答案为:B;
为3~4左右可以使滤液中的Zn2+等离子的萃取除杂率最好,B正确,故答案为:B;
(5)根据分析可知,将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为蒸发浓缩、降温结晶、过滤、洗涤等操作得到产品硫酸镍晶体,故答案为:蒸发浓缩;降温结晶(或冷却结晶);
(6)根据题意,取![]() 试液,消耗EDTA标准液的物质的量=0.02mol/L×0.0365L=7.3×10-4mol,根据反应
试液,消耗EDTA标准液的物质的量=0.02mol/L×0.0365L=7.3×10-4mol,根据反应![]() ,25mL试液中n(Ni2+)=n(EDTA)=7.3×10-4mol,则250mL试液中硫酸镍晶体的质量=
,25mL试液中n(Ni2+)=n(EDTA)=7.3×10-4mol,则250mL试液中硫酸镍晶体的质量=![]() ×7.3×10-4mol×263g/mol=1.9199g,则纯度为=
×7.3×10-4mol×263g/mol=1.9199g,则纯度为=![]() ×100%≈96.0%,故答案为:96.0。
×100%≈96.0%,故答案为:96.0。

【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知:
H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1
H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1
I2(g)=I2(s) ΔH=-37.48kJ·mol-1
化学键 | I—I | H—I |
键能/(kJ·mol-1) | 151 | 299 |
键能是将1mol气体分子AB断裂为中性气态原子A和B所需要的能量,单位为kJ·mol-1。
①Q=____kJ·mol-1。
②H—H键能为____kJ·mol-1。
(2)716K时,在恒容密闭容器中按物质的量之比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如图:

①若反应开始时气体混合物的总压为pkPa,则反应在前20min内的I2(g)平均速率![]() (I2)=___kPa·min-1(用含p的式子表示)。
(I2)=___kPa·min-1(用含p的式子表示)。
②在H2(g)+I2(g)![]() 2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,
2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,![]() =___(列出计算式)。
=___(列出计算式)。
③H2(g)+I2(g)![]() 2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
(3)一定条件下,NaClO可将溶液中的I-氧化为I2。通过测定体系的吸光度,检测到不同pH下I2的生成量随时间的变化关系如图。

已知:吸光度越高表明该体系中c(I2)越大。
①pH=4.8时,在___min附近c(I2)最大。
②10min时,不同pH与吸光度的关系是___。
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因是___。