题目内容
【题目】硫酸镁在工农业生产中有重要的作用。工业上以菱镁矿(主要成分为MgCO3,含少量FeCO3、SiO2等)为原料制备硫酸镁的流程如图:

(1)“酸溶”时MgCO3发生反应的离子方程式为___。
(2)滤渣的成分是___(填化学式)。
(3)加入H2O2氧化时,发生反应的离子方程式为___。
(4)将硫酸镁与木炭在800℃时煅烧,可以得到高纯度的MgO,煅烧过程中存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
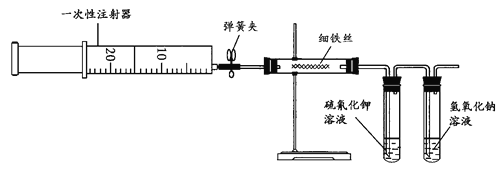
利用如图装置对煅烧产生的气体进行分步收集、吸收或处理。

①装置A中U型管放在冷水中的目的是___,收集的物质是___。
②装置B、C中所盛放的试剂分别是___、___(填化学式)。
③装置D的作用是___。
【答案】MgCO3+2H+=Mg2++CO2↑+H2O SiO2 2Fe2++2H++H2O2=2Fe3++2H2O 将气体冷却 S(或硫) (酸性)KMnO4溶液或(饱和)NaHCO3溶液 NaOH溶液 燃烧处理CO气体,防止污染空气
【解析】
(1)“酸溶”时MgCO3与稀硫酸反应生成硫酸镁、二氧化碳、水。
(2)MgCO3、FeCO3能溶于硫酸,SiO2难溶于硫酸。
(3)加入H2O2,亚铁离子被氧化为铁离子;
(4)①根据S在常温下是固体分析装置A中U型管放在冷水中的目的。
②高锰酸钾能吸收二氧化硫、不能吸收二氧化碳,氢氧化钠溶于能吸收二氧化碳。
③一氧化碳具有可燃性,用燃烧的方法处理一氧化碳。
(1)“酸溶”时MgCO3与稀硫酸反应生成硫酸镁、二氧化碳、水,反应的离子方程式为MgCO3+2H+=Mg2++CO2↑+H2O。
(2)MgCO3、FeCO3能溶于硫酸,SiO2难溶于硫酸,所以滤渣的成分是SiO2;
(3)加入H2O2,亚铁离子被氧化为铁离子,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O;
(4)①S在常温下是固体,装置A中U型管放在冷水中使硫蒸气冷凝下来,收集的物质是S。
②高锰酸钾能吸收二氧化硫、不能吸收二氧化碳,氢氧化钠溶于能吸收二氧化碳,所以装置B中所盛放的试剂是KMnO4溶液或NaHCO3溶液, C中所盛放的试剂NaOH溶液。
③一氧化碳具有可燃性,用燃烧的方法处理一氧化碳,防止污染空气。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应