题目内容
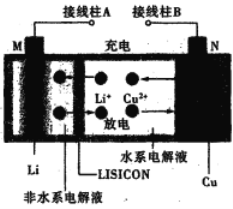
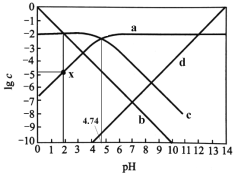
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是

A. M为电源负极,有机物被氧化
B. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移
C. 电池工作时,N极附近溶液pH增大
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
【答案】B
【解析】
A.由图可知,该电池中有机物在微生物的作用下发生氧化反应生成CO2,所以. M为电源负极,有机物被氧化,故A正确;
B.处理1 molCr2O72-时需要6mol电子,但是同时也会有定量的氧气得到电子,从交换膜左侧向右迁移的氢离子的物质的量大于6mol,故B错误;
C.有图可知,电池工作时,N极上氧气得到电子与氢离子结合成水,所以氢离子浓度减小,N附近溶液pH增大,故C正确;
D.由题可知,当Cr2O72-离子浓度较大时,其去除率几乎为0,又因为其有强氧化性和毒性,所以可能会造成还原菌的蛋白质变性而失活,故D正确。
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|