题目内容
17.下列叙述正确的是(NA表示阿伏伽德罗常数)( )| A. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| B. | 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子 | |
| C. | 在含有NH4+、Ba2+、Cl-、NO3-离子的溶液 加入过氧化钠以上各离子量几乎不减少 | |
| D. | 2H2O2(l)═2H2O(l)+O2(g);△H=-98.2 kJ/mol,△S=70.5 J/mol•K,该反应低温能自发进行 |
分析 A、7.8g过氧化钠粉含有的共用电子对数为0.1NA;
B、过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢失去2NA电子;
C、铵根离子与氢氧根离子反应生成氨水;
D、根据吉布斯自由能公式△G=△H-T△S分析.
解答 解:A、7.8g过氧化钠粉末物质的量为0.1mol,含有的共用电子对数为0.1NA,故A错误;
B、过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢失去2NA电子,故B错误;
C、过氧化钠与水反应生成NaOH,铵根离子与氢氧根离子反应生成氨水,故C错误;
D、根据吉布斯自由能公式△G=△H-T△S,低温能自发进行,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
相关题目
4.0.1mol/L的氨水与0.1mol/L盐酸等体积混合,混合液中各离子浓度关系正确的是( )
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||
| C. | c(NH4+)=c(Cl-)>c(H+)=c(OH-) | D. | c(NH4+)=c(Cl-)>c(H+)>c(OH-) |
5.下列各组试剂中,能用溴水加以鉴别的是( )
| A. | CH4与C3H8 | B. | 苯与己烯 | C. | 己烷与苯 | D. | 苯与甲苯 |
12.有核电荷数依次增大的5种元素:A、B、C、D、E,符合如表所示的性质:
(1)元素B的单质的用途是(任写一种):保护气、制氨气
(2)元素A和B中非金属性更强的元素是(填名称):氮,支持此结论的一种实验事实为硝酸的酸性比碳酸的酸性强
(3)元素C和D可以形成共价化合物C2D2,该化合物中各原子都达到8电子稳定结构,则该化合物的电子式为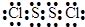
(4)已知液态CS2完全燃烧生成两种同价态的气体氧化物,若生成的两种气体总体积为3360mL(已折算为标准状况)时,反应放出Q (Q>0)kJ的热量,则表示CS2燃烧热的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-20QkJ•mol-1
(5)向B的气态氢化物水溶液中,通入A的最高价氧化物,可能得到两种盐:X和Y.同温下等浓度的X和Y的溶液中,pH更高的是(填名称)碳酸铵
(6)元素D和E形成的不与苯酚溶液显色的化合物为F,则检验F溶液中阳离子的方法为取少量溶液于试管中,滴加铁氰化钾溶液出蓝色沉淀,向F的溶液中加入过氧化钠可以得到红褐色沉淀,同时没有气体产生,则该反应过程中离子反应方程式为6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+6Na++2Fe3+(用一个总的离子方程式表示)
| A | 最外层电子数是电子层数的2倍,单质为黑色固体 |
| B | 单质是空气的主要成分之一 |
| C | 与B不同主族,单质为淡黄色固体,易溶于二硫化碳 |
| D | 一种非金属元素 |
| E | 与D形成的某种化合物的水溶液遇苯酚溶液显紫色 |
(2)元素A和B中非金属性更强的元素是(填名称):氮,支持此结论的一种实验事实为硝酸的酸性比碳酸的酸性强
(3)元素C和D可以形成共价化合物C2D2,该化合物中各原子都达到8电子稳定结构,则该化合物的电子式为
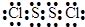
(4)已知液态CS2完全燃烧生成两种同价态的气体氧化物,若生成的两种气体总体积为3360mL(已折算为标准状况)时,反应放出Q (Q>0)kJ的热量,则表示CS2燃烧热的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-20QkJ•mol-1
(5)向B的气态氢化物水溶液中,通入A的最高价氧化物,可能得到两种盐:X和Y.同温下等浓度的X和Y的溶液中,pH更高的是(填名称)碳酸铵
(6)元素D和E形成的不与苯酚溶液显色的化合物为F,则检验F溶液中阳离子的方法为取少量溶液于试管中,滴加铁氰化钾溶液出蓝色沉淀,向F的溶液中加入过氧化钠可以得到红褐色沉淀,同时没有气体产生,则该反应过程中离子反应方程式为6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+6Na++2Fe3+(用一个总的离子方程式表示)
7.铁-镍蓄电池充电放电时发生的反应为:Fe+NiO2+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2,关于此蓄电池的下列说法中不正确的是( )
| A. | 放电时负极附近溶液的碱性不变 | |
| B. | 充电时阴极的电极反应式为Ni(OH)2═NiO2+2H++2e- | |
| C. | 放电时NiO2的反应为NiO2+2e-+2H2O═Ni(OH)2+2OH- | |
| D. | 利用蓄电池电解饱和食盐水,阳极产生标准状况下8.4LCl2,则理论上电路中通过电子物质的量为0.75mol |

 .
.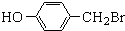 ,
,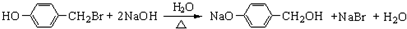
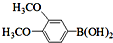 与化合物
与化合物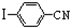 在一定条件可发生类似反应①的反应,其产物的结构简式为
在一定条件可发生类似反应①的反应,其产物的结构简式为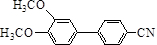 .
.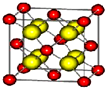 已知A、B、C、D四种短周期主族元素位于同一周期,且它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、E同主族.F、G都是第四周期元素,F原子核外有4个未成对电子,G原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期主族元素位于同一周期,且它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、E同主族.F、G都是第四周期元素,F原子核外有4个未成对电子,G原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,
, .
.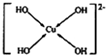 (需要用箭头指出配位键).
(需要用箭头指出配位键).
 回答下列问题:
回答下列问题: .
.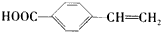 .
.